Фотохімічний реакційний центр
Фотохімічний рекційний центр — комплекс білків, пігментів та інших кофакторів, взаємодія яких забезпечує реакцію перетворення світлової енергії в хімічну при фотосинтезі. Центр отримує енергію або безпосереднім збудженням однієї зі своїх молекул або від світлозбірного комплексу, до складу якого входять хромофори на зразок хлорофілу та хінони. Поглинаючи квант світла, молекули пігментів переходять у збуджений стан. Їхня енергія передається одному з акцепторів електрона. Цим розпочинається ланцюжок хімічних реацій, наслідком яких є перетворення енергії в хімічну.
Реакційні центри є у всіх зелених рослин, водоростей та багатьох бактерій. Попри те, що різні види розділені мільярдами років еволюції, реаційні центри гомологічні в усіх видів, тоді як існує велика різноманітність світлозбірних комплексів. Зелені рослини й водорості мають два різні типи реакційних центрів, що належать до суперкомплексів фотосинтез I P700 та фотосинтез II P680. Суперкомплесли великі й мають багато світлозбірних комплексів, зрозуміти взаємодію яких важко. Найкраще зрозумілі центри реакції бактерій Rhodopseudomonas, що мають менше поліпептидних ланцюжків[1].
Реакційний центр організований так, що отримує енергію фотона від однієї з молекул пігмента й перетворює її в форму, зручну для використання.
Транспорт електрона
Електронне збудження молекули призводить до зменшення потенціалу відновлення, тобто молекула легше віддає електрони, що є ключовим фактором в перетворенні енергії електронного збудження в хімічну. Зелені рослини мають численні акцептори електронів, упорядковані в ланцюжки електронного транспорту, куди входять феофітини, хінони, пластохінони, цитохроми bf та фередоксини. Завершують ланцюжок відновлені молекули NADPH. Проходження електрона через транспортний ланцюжок призводить також до втягування протонів зі строми хлоропласта в лумен, завдяки чому утворюється градієнт протонів у тилакоїдній мембрані, який клітина може використати для синтезу АТФ з використанням АТФ-синтази. Як NADPH, так і АТФ, використовуються у циклі Кальвіна фіксації Карбону.
Бактерії
Структура
Розуміння структури реакційних центрів та хімії біологічних процесів засвоєння світлової енергії прийшло завдяки вивченню реакційних центрів бактерій.
Родерік Клейтон першим виділив у 1960-х роках реаційний центр пурпурової бактерії. Кристалічну структуру вперше визначили 1982 року Гартмут Міхель, Йоганн Дайзенгофер та Роберт Губер[2], за що 1988 року отримали Нобелівську премію[3]. Значення цього відкриття було тим більше, вперше було розшифровано структуру будь-якого мембранного білкового комплексу.
Для функціонування реакційного центра важливі чотири структурні одиниці. Це L та M субодиниці, що пронизують подвійний ліпідний шар мембрани. Структурно вони схожі між собою, обидві мають 5 трансмембранних альфа спіралей[4]. Чотири бактеріохлорофіли b (BChl-b), два бактеріофеофітини b (BPh), два хінони (QA та QB) та іон заліза, зв'язаний з L та M субодиницями. Субодиниця H лежить з цитоплазмотичного боку плазмової мембрани. Цитохромна субодиниця містить 4 геми с-типу й лежить на периплазмовій поверхні мембрани. Наявність цієї субодиниці в бактеріях не обов'язкова. Субодиниці L та M зв'язують функціональні кофактори зі світлочутливими кофакторами.
Реакційні центри різних видів бактерій можуть мати дещо різні бактеріохлорофіли й бактеріофеофітити. Завдяки цій мінливості змінюється колір світла, який поглинають бактерії, а це сприяє утворення особливих ніш фотосинтезу. Реакційний центр містить два пігменти, що виконують функції збору й передачі енергії поглинутого фотона: BChl та Bph. BChl нагадує за будовою молекулу хролофіру зелених рослин, але, завдяки невеликим структурним відмінностям, має пік поглинання в інфрачервоній області з довжиною хвилі до 1000 нм. Bph має майже ту ж будову, що й BChl, але центральний атом Магнію в ньому заміщений двома протонами. Це заміщення призводить як до зміни максимуму поглинання, так і до зменшення відновного потенціалу.
Механізм
Процес розпочинається, коли світло поглинається двома молекулами BChl (димером) на периплазмовому боці мембрани. Ця пара, яку часто називають особливою, поглинає фотони з довжиною хвилі 870 та 960 нм у залежності від виду, а тому її називають P870 (у rhodobacter sphaeroides) або P960 (rhodopseudomonas viridis). Після поглинання фотона у вузлі L відбувається перенос заряду від Bchl до BPh. Пігмент залишається позитивно зарядженим, тоді як BPh отримує негативний заряд перенесеного електрона. Цей процес триває приблизно 10 пкс[1].
На цій стадії заряди на особливій парі можуть рекомбінувати. При цьому енергія фотона перетворюється в тепло. Реакційний центр має кілька механізмів запобігання цьому небажаному процесу. Перш за все перенос електрона відбувається відносно повільно в порівнянні з двома іншими окисно-відновлювальними реакціями: переносом електрона від BPh до хінону (QA) та переносом електрона до пігмента з гемом в цитохромному вузлі над реакційним центром.
Високоенергетичний електрон, локалізований на міцно зв'язаній молекулі хінону QA переходить до молекули хінону QB. Ця молекула слабо асоційована з білком і легко відривається. Для того, щоб повністю відновити QB до QH2 потрібні два високоенергетичні електрони. При цьому два протони беруться з цитоплазми. Відновлений хінон QH2 дифундує через мембрану до іншого білкового комплексу — цитохромного комплексу bc1, де відбувається окиснення. У цьому процесі відновний потенціал QH2 використовується для того, щоб пропомпувати два протони через мембрану в периплазмовий простір. Електрони переходять з комплексу bc1 через посередник c2 до цитохромної субодиниці в периплазмі, забезпечуючи циклічність транспорту електронів.
Зелені рослини
Фотосинтез з виділенням кисню
1772 року хімік Джозеф Прістлі провів цикл експериментів з газами, які беруть участь у процесах дихання та горіння. У першому експерименті від запалив свічку й помістив її під перевернутий дзбан. Через деякий час свічка погасла. Далі він провів аналогічний експеримент з мишою. Миша померла незабаром після того, як погасла свічка. Виявилося також, що повітря можна оживити, яка помістити в герметичну посудину зелені рослини, надавши їм доступ до світла. Спостереження Прістлі були одними з перших демонстрацій діяльності фотохімічних реакційних центрів.
1932 року професор Роберт Емерсон та студент Вільям Арнолд використали методику спалахів, щоб точно виміряти невеликі кількості кисню, виробленого хролофілом водорості Chlorella. Своїми експериментами вони доказали існування фотохімічного центру. Пізніше Гаффрон та Воль пояснили результати досліду, збагнувши, що енергія світла, поглинута хлорофілами, передається в інше місце[5], яке отримало назву фотохімічного центру фотосистеми II. Такий процес властивий ціанобактеріям, водоростям і зеленим рослинам[6].
Фотосистема II
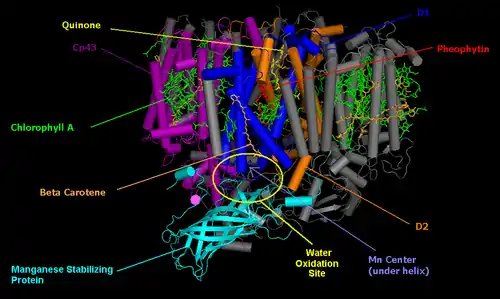
Фотосистема II продукує два електрони, призначені для відновлення NADP+ у фередоксин-NADP-редуктазі. Вона міститься в тилакоїдних мембранах всередині хролопластів, де в зелених рослинах відбуається фотосинтез[7]. За своєю будовою вона напрочуд схожа на фотохімічний центр бактерій, що дозволяє припустити існування спільного предка.
Основними складовими частинами фотосистеми II є дві субодиниці, які називають D1 та D2. Ці дві субодиниці аналогічні субодиницям L та M фотохімічних центрів бактерій. Вона відрізняється від субодиниць бактеріальних центрів додатковими субодинимцями з хролофілами, що підвищує її ефективність. Загальну формулу реакції в фотосистемі II можна записати як:
,
де Q позначає пластохінон, а QH2 пластохінол. Процес відновлення хінону схожий на аналогічний процес у фотохімічних центрах бактерій. Фотосистема II отримує електони з води через процес фотолізу.
Побічним продуктом цього процесу є молекулярний кисень, і саме завдяки цьому зелені рослини збагачують киснем повітря. Той факт, що кисень, який виробляють зелені рослини, береться з води, першим теоретизував Мартін Девід Камен. Для того, щоб відстежити шлях атома Оксигену від води до молекулярного кисню, він використав природний стабільний ізотоп Оксигену 18O. Реакцію фотолізу води в фотохімічному центрі фотосистеми II каталізує білковий комплекс з чотирма іонами Мангану.
Як і в фотохімічному центрі бактерій процес починається з поглинання світла парою молекул хлорофілу. Зелені рослини використовуть хлорофіл-a, а не бактеріохлорофіл, завдяки чому поглинають світло з меншою довжиною хвилі. Пару хлорофілів фотохімічного реакційного центру часто називають P680[1]. Після поглинання фотона, електони з високою енергією переходять до молекул феофітину.
Електрон переходить від молекули феофітину до двох молекул пластохінону, одну міцно прикріплену, другу зв'язану слабо, аналогічно тому, як це відбувається в бактеріальних реакційних центрах. Для повного відновлення слабо зв'язаної молекули пластохінону потрібно два електрони.
Фотосистема II відрізняється від реакційного центру бактерій джерелом електронів, що нейтралізують пару молекул хлорофілу-a. У бактеріях електрони беруться з відновленої групи геми в цитохромній субодиниці або з розчинного у воді білка цитохроми-c.
Після завершення процесу розділення заряду молекула P680 залишається додатньо зарядженою. Вона є дуже сильним окисником і відбирає два електрони у молекул води, асоційованих з мангановим центром, розташованим неподалік. Крім чотирьох іонів Мангану цей центр має іон Кальцію, іон Хлору й тирозиновий залишок. Ефективність Мангану зумовлена тим, що він має чотири стани окиснення: Mn2+, Mn3+, Mn4+ та Mn5+. Крім того Манган сильно зв'язується зі сполуками, що містять Оксиген, наприклад, з водою.
Поглинаючи фотон, P680 втрачає електрон і отримує додатний заряд. Цей заряд нейтралізується, отримуючи електрон від манганового центру. Для окиснення води потрібно чотири електрони. Саме ці молекули води є джерелом електронів, що відновлюють дві молекули Q до QH2. Такий каталічний центр розщеплення води досі не вдається відтворити жодним штучним каталізатором.
Фотоситема I
Покинувши фотосистему II, електрон переноситься до цитохромного комплексу b6f, а від нього до пластоціаніну. Пластоціаніновий комплекс передає електрон наступному фотохімічному реакційному центру, який називають фотосистемою I.
Як і в фотосистемі II та реаційному центрі бактерій, процес починається з пари молекул хролофілу-a, в якій відбувається фотоіндуковане розділення заряду. Цю пару називають P700, де 700 означає довжину хвилі максимального поглинання молекул хролофілу. P700 розташована в центрі молукули білка. Після розділення заряду, електрон переноситься через транспортний ланцюжок до молекули хлорофілу-α, до молекули хінону, через три кластери 4Fe-4S до фередоксинового комплексу. Фередоксин є розчинним білком, що містить кластер 2Fe-2S, координований чотирма цистеїновими залишками. Додатній заряд, що залишається на P700, нейтралізується переходом електронів з пластоціаніну. Загальна формула реації у фотосистемі I має вигляд:
Взаємодія між фотосистемами I та II створює потік електронів від H2O до NADP+. Його називають Z-схемою, оскільки редокс діаграма від P680 до P700 схожа на літеру z[8].
Виноски
- Biochemistry: Fifth Edition, Chapter 19.
- X-Ray Structure Analysis of a Membrane Protein Complex. Electron Density Map at 3 Angstroms Resolution and a Model of the Chromophores of the Photosynthetic Reaction Center from Rhodopseudomonas Viridis. Deisenhofer et al. J.MOL.BIOL. vol:180, pag:385 (1984)
- http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1988/
- Photosynthetic reaction centres of purple bacteria Архівовано 14 травня 2006 у Wayback Machine. (2 February 1999). Retrieved Feb 28, 2010.
- Mohammad Yunus et al. (2000). Milestones in Photosynthesis Research. Retrieved Feb 28, 2010.
- Gary E. Kaiser (Feb. 24, 2003)Oxygenic photosynthesis Bacterial growth and microbial metabolism. Retrieved Feb 28, 2010.
- The chloroplast Архівовано 3 серпня 2003 у Wayback Machine. (10 August 2003) Ultranet biology
- The Z-Scheme Diagram of Photosynthesis, by Rajni Govindjee. Retrieved Feb 28, 2010.
Джерела
- Jeremy M. Berg et al. (2002). Biochemistry Fifth Edition ISBN 0-7167-4684-0
- Robin Ghosh et al. Department of Bioenergetics, Institute of Biology. URL accessed on February 28, 2010.
- Protein Data Bank. URL accessed on February 28, 2010.
- Kimberley A. McGrath et al. (1999). World of biology ISBN 0-7876-3044-6