SNARE
SNARE (від англ. soluble NSF attachment receptor) — велика група білків, що здійснюють злиття внутрішньоклітинних транспортних везикул з цитоплазматичною мембраною (екзоцитоз) або органелою-мішенню, такою як лізосома. Нараховується близько 60 білків SNARE. Білки групи діляться на дві функціональні категорії: везикулярні білки (v-SNARE) і білки приймаючої органели (t-SNARE). Нова структурна класифікація підрозділяє групу на R-SNARE та Q-SNARE. Найбільш вивчені білки, які здійснюють доставку синаптичних везикул до пресинаптичної мембрани і їх злиття. Ці білки є мішенями небезпечних бактеріальних токсинів ботулізму і правця[2]. SNARE-білки відповідають за всі внутрішньоклітинні злиття мембран. Відомо понад 30 представників сімейства SNARE в клітинах ссавців, кожен з яких притаманний певному субклітинному відділу. SNAREs також забезпечують деякі аспекти специфічності транспорту в мембрани. Функціональні дослідження вказують на те, що білки SNARE взаємодіють один з одним, щоб створити рушійну силу, необхідну для злиття ліпідних бішарів.
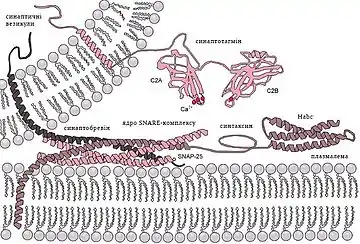
SNARE-гіпотеза
Для пояснення екзоцитозу була запропонована SNARE-гіпотеза, або гіпотеза про універсальну одиницю стикування і злиття. Гіпотеза припускає, що в процесі стикування і злиття беруть участь такі білки, як v-SNARE (або везикулярний SNAP-рецептор), t-SNARE, або мембранний рецептор для SNAP (він є мішенню для v-SNARE), цитозольні білки NSF (n-ethylmaleimide-sensitive-factor) і SNAP-білок (synaptosomal-associated protein), який є адаптором до NSF. Стикування везикули здійснюється завдяки комплементарності v-SNARE і t-SNARE. Ці два білки-рецептори взаємодіють один з одним за принципом «антиген-антитіло». Після контакту, тобто коли вони зв'яжуться між собою, обидва цих білки стають рецепторами для SNAP, який в свою чергу приєднує NSF. При цьому комплекс v-SNARE + t-SNARE + Са-канал є віссю, на яку нанизуються інші молекули, що беруть участь в екзоцитозі. Гідроліз АТФ за участю NSF веде до просторової реорганізації SNARE-комплексу, що приводить синаптичну везикулу в стан праймінгу. Вхід кальцію дестабілізує SNARE-комплекс везикули і призводить до екзоцитозу.[3][4]
В цілому, послідовність подій від моменту приходу везикули в пул 1 до моменту її праймінгу можна представити таким чином:
| v-SNARE + t-SNARE → стикування везикули → v-SNARE + t-SNARE + SNAP → праймінг везикули |
|---|
Структура
Білки SNARE є невеликими, але широко представленими мембранними білками. Незважаючи на велику різницю у структурі та розмірі ці білки об'єднує наявність одного і того ж цитозольного домену з 60-70 амінокислот, який наивається SNARE motif (або SNARE домен), здатного до утворення оборотного, але міцного чотирьохспірального зчеплення. Такий метастабільний транс-SNARE комплекс включає синтаксин 1 і SNAP-25, що знаходяться на клітинній мембрані, і синаптобревін на поверхні пресинаптичної везикули. Синтаксин і синаптобревін пов'язані з мембраною С-кінцевим фрагментом і надають по одній альфа-спіралі в чотирьохспіральне зчеплення комплексу. SNAP-25 заякорений на мембрані за рахунок пальмітоільних ацильних ланцюгів і забезпечує дві інші альфа-спіралі.
Механізм злиття
Злиття мембран відіграє важливу роль в різних біологічних процесах, включаючи підтримку базової клітинної організації у еукаріот. Злиття везикули здійснюється багатьма скоординованими стадіями, такими як знаходження цілі, зв'язування з нею, і первинне та фінальне злиття. Наразі відомо більше сотні SNARE-білків, і більшість з них розподілено на три родини – синтаксини, VAMPs і SNAP-25 родину. Характерною особливістю всіх SNARE-білків є їх суперскручені домени (ділянки, де вторинна білкова α-спіраль закручується в спіраль більш високого порядку).
Спочатку вважали, що SNARE-білки забезпечують специфічне зв'язування (докінг). Однак, потім було встановлено, що вони скоріше беруть участь у злитті, ніж в підтриманні везикул.
SNAREs з'єднуються один з одним, утворюючи дуже стабільні 4-нитчасті суперскручені стрижневі комплекси.[6] Нейрональні стрижневі комплекси формуються однією спіраллю кожного з синтаксинів і VAMP, та двома спіралями із SNAP-25. Молекулярний механізм, що регулює утворення стрижневого комплексу, досі невідомий. Синтаксини мають великий N-термінальний домен, який взаємодіє зі скрученим доменом у присутності шаперона n-Sec1. Після конфірмаційної зміни, що запускається за допомогою невідомих механізмів, синтаксин відкривається, що дає можливість скрученому домену брати участь у збірці стрижневого комплексу, сприяючи тим самим злиття.
SNAREs двох мембран взаємодіють, формуючи оборотні комплекси перед запуском фінального злиття. Згідно з наявною моделлю, везикули, захоплені за допомогою Rab-білків та/або інших факторів, транспортуються до SNAREs. Збірка стрижневого комплексу SNARE потім направляє дві мембрани назустріч одна одній і створює відповідне викривлення і натяг мембран. Коли мембрани досить зближені, відбувається напівзлиття в результаті злиття отворів пор та їх розширення, потім відбувається повне злиття мембран.[7]
Дослідження
- Комбінуючи методи біохімії, молекулярної і клітинної біології, Ренді Шекману вдалося ідентифікувати кілька ключових білків, зв'язаних з синаптичними везикулами і плазматичною мембраною. Ці білки беруть участь в процесі злиття везикул, які містять нейронтрансміттер, з пресинаптичною терміналлю. Зокрема, Шекман вперше охарактеризував білок v-SNARE або VAMP, зв'язаний з везикулярною мембраною, а також вперше знайдені білки плазматичної мембрани t-SNARE (синтаксин) і SNAP-25. Ці білки пов'язані з процесом злиття синаптичних везикул і мембрани при вивільненні нейромедіатора.
- Томас Зюдгоф використовував дані біохімії і молекулярної біології для ідентифікування білків, що відіграють важливу роль у роботі синаптичних везикул. Він відкрив, що один з білків везикулярної мембрани – синаптотагмін – має два окремих домени: один для зв'язування з кальцієм, інший з фосфоліпідним шаром мембрани. Це вказало на його потенційну значимість для вивільнення нейромедіатора, так як підвищення внутрішньоклітинної концентрації кальцію супроводжує активацію нейрона. За допомогою методів створення трансгенних тварин Зюдхоф з'ясував функціональну роль синаптотагміна і декількох інших везикулярний білків, необхідних для швидкого викиду нейромедіатора при появі кальцієвого сигналу.
- Джеймс Ротман розробив безклітинний метод аналізу основних процесів мембранного переносу в клітині. Він знайшов два розчинних білка - NSF і SNAP, критичних для везикулярного транспорту і злиття з мембраною в клітинах, що не відносяться до нервової тканини. Він виявив, що при приміщенні в екстракт з мозку ці білки утворюють комплекси з везикулярним білком VAMP і білками плазматичної мембрани (ідентифікованими раніше Шеллером) - синаптотаксином та SNAP-25. Як виявилося, третинний комплекс везикулярного білка v-SNARE і двох білків плазматичної мембрани t-SNARE є основою не тільки для вивільнення нейромедіатора в нервових клітинах, але і у всіх формах злиття клітинних мембран. SNARE-забезпечуване злиття високо специфічне, але ця специфічність протестована тільки з використанням 4-х SNAREs між двома бішарами. Оскільки кожен відділ секреторного шляху може містити безліч SNAREs в одному бішарі, Ротман вирішив вивчити ефект п'ятого SNARE на чотири родинних SNAREs. У «The Journal of Cell Biology» він повідомив про ідентифікацію нового функціонального класу SNAREs – inhibitory (i-SNAREs).
За свої роботи в галузі дослідження везикулярного транспорту Ренді Шекман, Джеймс Ротман та Томас Зюдгоф отримали Нобелівську премію в області фізіології та медицини за 2013 рік[8].
Джерела
- Lang T, Jahn R (2008). Core proteins of the secretory machinery. Handb Exp Pharmacol (184): 107–27. doi:10.1007/978-3-540-74805-2_5. PMID 18064413.
- Brunger AT, Jin R, Breidenbach MA (April 2008). Highly specific interactions between botulinum neurotoxins and synaptic vesicle proteins. Cell. Mol. Life Sci. doi:10.1007/s00018-008-8088-0. PMID 18425411.
- Lyshevski, Sergey Edward, ed. (2007). "Subneuronal processing of information by solitary waves and stochastic processes". Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17–1–17–41. ISBN 978-0-8493-8528-5.
- Сидоров, А. В. "Физиология межклеточной коммуникации" : учеб. пособие – Минск : БГУ, 2008. – 215 с. ISBN 978-985-485-812-8.
- Cho SJ, Kelly M, Rognlien KT, Cho JA, Horber JK, Jena BP (2002). "SNAREs in opposing bilayers interact in a circular array to form conducting pores". Biophys J. 83 (5): 2522–7. PMC 1302338. PMID 12414686
- Sutton RB, Fasshauer D, Jahn R, Brünger AT (1998). "Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 Å resolution". Nature 395 (6700): 347–353. doi:10.1038/26412. PMID 9759724
- Fasshauer D, Sutton RB, Brunger AT, Jahn R (1998). "Conserved structural features of the synaptic fusion complex: SNARE proteins reclassified as Q- and R-SNAREs". Proceedings of the National Academy of Sciences 95 (26): 15781–15786. doi:10.1073/pnas.95.26.15781. PMC 28121. PMID 9861047
Посилання
- Lyshevski, Sergey Edward, ред. (2007). Subneuronal processing of information by solitary waves and stochastic processes. Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. с. 17–1–17–41. ISBN 978-0-8493-8528-5. Архів оригіналу за 16 січня 2016. Процитовано 8 квітня 2013.
- Gerald K (2002). Cell and Molecular Biology (4th edition). John Wiley & Sons, Inc.
- Cho SJ, Kelly M, Rognlien KT, Cho JA, Horber JK, Jena BP (2002). SNAREs in opposing bilayers interact in a circular array to form conducting pores. Biophys J. 83 (5): 2522–7. PMC 1302338. PMID 12414686.
- Cho WJ, Jeremic A, Jena BP (2005). Size of supramolecular SNARE complex: membrane-directed self-assembly. J. Am. Chem. Soc. 127 (29): 10156–7. PMID 16028912. doi:10.1021/ja052442m.
- Sutton RB, Fasshauer D, Jahn R, Brünger AT (1998). Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 Å resolution. Nature 395 (6700): 347–353. PMID 9759724. doi:10.1038/26412. Архів оригіналу за 10 вересня 2006. Процитовано 8 квітня 2013.
- Fasshauer D, Sutton RB, Brunger AT, Jahn R (1998). Conserved structural features of the synaptic fusion complex: SNARE proteins reclassified as Q- and R-SNAREs. Proceedings of the National Academy of Sciences 95 (26): 15781–15786. PMC 28121. PMID 9861047. doi:10.1073/pnas.95.26.15781.
- Diao J et al. (2010). A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nature Communications 1 (5): 54. doi:10.1038/ncomms1054.
- Press release of The Nobel Assembly at Karolinska Institutet on the 2013 Nobel Prize in Physiology or Medicine