Ізотопи берилію
Берилій (Be) має 12 відомих ізотопів, але лише один із них (9Be) є стабільним і примордіальним нуклідом. Таким чином, берилій вважають моноізотопним елементом. Він також є мононуклідним елементом, оскільки всі інші його ізотопи мають настільки короткий період напіврозпаду, що жоден із них не є примордіальним і вони надзвичайно малопоширені. Берилій унікальний в тому сенсі, що це єдиний моноізотопний елемент, в ядрі якого парне число протонів і непарне число нейтронів. Всі інші 25 моноізотопних елементів мають непарні атомні номери і парне число нейтронів.
Серед 11 радіоізотопів берилію найстабільнішим є 10Be з періодом напіврозпаду 1,39 мільйона років, а також 7Be з періодом напіврозпаду 53,22 дня. Всі інші радіоізотопи мають період напіврозпаду менш як 13,85 секунди, більшість з них - 20 мілісекунд. Найменш стабільним ізотопом є 6Be з періодом напіврозпаду 5,03 × 10−21 секунди.
Природне для легких елементів рівне співвідношення протонів і нейтронів порушується через надзвичайну нестабільність 8Be перед альфа-розпадом, в напрямку якого йде реакція завдяки надзвичайно сильним зв'язкам всередині ядра 4He. Період напіврозпаду 8Be становить лише 6,7(17)×10−17 секунди.
Берилій не може мати стабільного ізотопа з 4 протонами і 6 нейтронами через дуже велике співвідношення між кількістю нейтронів і протонів як для такого легкого елемента. Втім, цей ізотоп, 10Be, має період напіврозпаду 1,39 мільйона року, що показує незвичну стабільність як для легкого нукліду з таким великим відношенням кількості нейтронів до протонів. У інших можливих ізотопів берилію цей показник становить навіть більшу величину, тож вони менш стабільні.
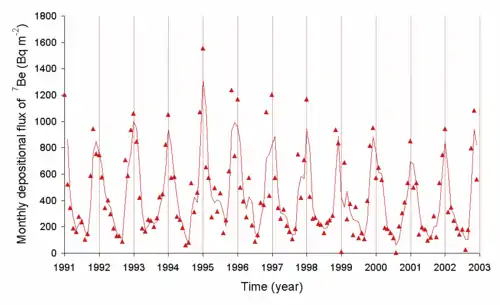
Вважають, що більшість 9Be у Всесвіті утворилась під дією космічних променів у проміжку між Великим вибухом і утворенням Сонячної системи. Ізотопи 7Be, з періодом напіврозпаду 53 дні, та 10Be обидва є космогенічними нуклідами, оскільки вони утворились нещодавно в сонячній системі під дією космічних променів, подібно до 14C. Зміна у поширеності цих двох радіоізотопів обумовлена циклами сонячної активності, що впливає на магнітне поле, яке захищає Землю від космічних променів. Швидкість, з якою короткоживучий 7Be випадає з атмосфери в ґрунт, обумовлена частково погодою. Розпад 7Be на Сонці є одним з джерел сонячних нейтрино, і першим типом, зареєстрованим під час гоумстейкського експерименту. Наявність 7Be в осадах часто допомагає встановити, що їхній вік становить менш як 3–4 місяці, що дорівнює двом періодам напіврозпаду 7Be.
Таблиця
| Символ ізотопу |
Z(p) | N(n) | маса ізотопу (u) |
період напіврозпаду | типи розпаду[1][n 1] |
Дочірні ізотопи[n 2] | Спін і парність ядра[n 3] |
Поширеність ізотопу в природі (мольна частка) |
діапазон розподілу в природі (мольна частка) |
|---|---|---|---|---|---|---|---|---|---|
| 5Be | 4 | 1 | 5.04079(429)# | p | 4Li | (1/2+)# | |||
| 6Be | 4 | 2 | 6.019726(6) | 5.0(3)×10−21 с [0.092(6) MeV] |
2p | 4He | 0+ | ||
| 7Be[n 4] | 4 | 3 | 7.01692983(11) | 53.22(6) d | ЕЗ | 7Li | 3/2− | Сліди[n 5] | |
| 8Be[n 6] | 4 | 4 | 8.00530510(4) | 6.7(17)×10−17 с [6.8(17) еВ][джерело?] |
α | 4He | 0+ | ||
| 9Be | 4 | 5 | 9.0121822(4) | Стабільний | 3/2− | 1.0000 | |||
| 10Be | 4 | 6 | 10.0135338(4) | 1.39×106 року | β− | 10B | 0+ | Сліди[n 5] | |
| 11Be[n 7] | 4 | 7 | 11.021658(7) | 13.81(8) s | β− (97.1%) | 11B | 1/2+ | ||
| β−, α (2.9%) | 7Li | ||||||||
| 12Be | 4 | 8 | 12.026921(16) | 21.49(3) мс | β− (99.48%) | 12B | 0+ | ||
| β−, n (0.52%) | 11B | ||||||||
| 13Be | 4 | 9 | 13.03569(8) | 2.7x10−21 с | n | 12Be | 1/2+ | ||
| 14Be[n 8] | 4 | 10 | 14.04289(14) | 4.84(10) мс | β−, n (81.0%) | 13B | 0+ | ||
| β− (14.0%) | 14B | ||||||||
| β−, 2n (5.0%) | 12B | ||||||||
| 15Be | 4 | 11 | 15.05346(54)# | <200 нс | |||||
| 16Be | 4 | 12 | 16.06192(54)# | <200 нс | 2n | 14Be | 0+ | ||
| 17Be | 4 | 13 | |||||||
- Скорочення:
ЕЗ: електронне захоплення - Жирним для стабільних ізотопів
- Спіни зі слабким оцінковим обґрунтуванням взяті в дужки.
- Утворився під час нуклеосинтезу Великого вибуху, але нині не є примордіальним, оскільки весь швидко розпався до 7Li
- космогенний
- Проміжний продукт потрійної альфа-реакції під час зоряного нуклеосинтезу у процесі утворення 12C
- Має 1 нейтрон гало
- Має 4 нейтрони гало
Нотатки
- Оцінки, позначені #, отримані не з чисто експериментальних даних, але частково з загальних тенденцій.
Ланцюги розпаду
Більшість ізотопів берилію розпадаються в процесі бета-розпаду і/або комбінації бета розпаду й альфа-розпаду, або нейтронного розпаду. Однак, 7Be розпадається лише в процесі електронного захоплення, цьому процесові зазвичай приписують незвичайно довгий період напіврозпаду. Також незвичним є 8Be, який розпадається через альфа-розпад до 4He. Цей альфа-розпад часто вважають поділом, що могло б пояснити незвичайно короткий період напіврозпаду.
Посилання
- Universal Nuclide Chart. nucleonica.
- Маси ізотопів взято з:
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- Кількісні співвідношення ізотопів і стандартні атомні маси взято з:
- J. R. de Laeter; J. K. Böhlke; P. De Bièvre; H. Hidaka; H. S. Peiser; K. J. R. Rosman; P. D. P. Taylor (2003). Atomic weights of the елементs. Review 2000 (IUPAC Technical Report). Pure and Applied Chemistry 75 (6): 683–800. doi:10.1351/pac200375060683.
- M. E. Wieser (2006). Atomic weights of the елементs 2005 (IUPAC Technical Report). Pure and Applied Chemistry 78 (11): 2051–2066. doi:10.1351/pac200678112051. Загальний огляд.
- Період напіврозпаду, спін, і дані ізомерів взято з: See editing notes on this article's talk page.
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- National Nuclear Data Center, Brookhaven National Laboratory. Information extracted from the NuDat 2.1 database (retrieved Sept. 2005).
- N. E. Holden (2004). Table of the Ізотопи. У D. R. Lide. CRC Handbook of Chemistry and Physics (вид. 85th). CRC Press. Section 11. ISBN 978-0-8493-0485-9.
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||