Ізотопи бору
Ізотопи бору - нукліди хімічного елементу бору, які мають різну кількість нейтронів, а, отже, різну атомну масу.
Загальний опис
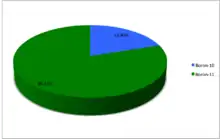
Природний бор складається тільки з двох стабільних ізотопів. На частку легкого бору-10 в природній суміші припадає близько 19,9%, решта, а саме 80.1% — важкий бор-11[1][2]. Деякі вчені вважають, що відношення 11В : 10В = 81 : 19 непостійне і що в надрах Землі відбувається частковий розподіл і перерозподіл ізотопів бору. На думку інших, всі відхилення в ізотопному складі — від того, що визначають його різними приладами і методами; але в роботах вчених і цієї групи, говориться, що бор, виділений з морської води, на 2% важчий за бор, добутий з мінералів. Існує, щоправда, й інше пояснення відхилень в ізотопному складі бору, добутого з різних зразків. Суть його в тому, що під дією швидких протонів частина бору-10 перетворюється на берилій-7, а той у свою чергу (після серії ядерних перетворень) — в гелій-4.
За величиною перетину захоплення теплових нейтронів легкий ізотоп бору 10В посідає одне з перших місць серед всіх ізотопів елементів, а важкий 11В — одне з найостанніших. Це означає, що матеріали на основі обох ізотопів елементу №5 вельми цікаві для реакторобудування, як, втім, і для інших областей атомної техніки.
Окрім цих відомі ще 12 радіоактивних ізотопів бору з масовими числами від 6В до 19В, найстійкішим з котрих є радіоізотоп 8В з періодом напіврозпаду 0,77 секунд. Всі решта ізотопів мають період напіврозпаду менший, ніж 17,35 мс, а для найменш стабільного з них, 7B, ця величина становить 150 йоктосекунд. Ізотопи з атомними масами меншими 10 розпадаються до гелію (7B і 9B за посередництва короткоживучих ізотопів берилію), а ті, що мають масу понад 10, здебільшого перетворюються на вуглець.
Таблиця
| Символ ізотопу |
Z(p) | N(n) | маса ізотопу (u) |
період напіврозпаду | типи розпаду[3] |
Дочірні ізотопи | Спін і парність ядра |
Поширеність ізотопу в природі (мольна частка) |
діапазон розподілу в природі (мольна частка) |
|---|---|---|---|---|---|---|---|---|---|
| 6B | 5 | 1 | 6.04681(75)# | ||||||
| 7B | 5 | 2 | 7.02992(8) | 350(50)×10−24 с [1.4(2) МеВ] |
p | 6Be[n 1] | (3⁄2−) | ||
| 8B[n 2] | 5 | 3 | 8.0246072(11) | 770(3) мс | β+, α | 2 4He | 2+ | ||
| 9B | 5 | 4 | 9.0133288(11) | 800(300)×10−21 с [0.54(21) кеВ] |
p | 8Be[n 3] | 3⁄2− | ||
| 10B | 5 | 5 | 10.0129370(4) | Стабільний | 3+ | 19.9(7) | 18.929–20.386 | ||
| 11B | 5 | 6 | 11.0093054(4) | Стабільний | 3⁄2− | 80.1(7) | 79.614–81.071 | ||
| 12B | 5 | 7 | 12.0143521(15) | 20.20(2) мс | β− (98.4%) | 12C | 1+ | ||
| β−, α (1.6%) | 8Be[n 4] | ||||||||
| 13B | 5 | 8 | 13.0177802(12) | 17.33(17) мс | β− (99.72%) | 13C | 3⁄2− | ||
| β−, n (0.279%) | 12C | ||||||||
| 14B | 5 | 9 | 14.025404(23) | 12.5(5) мс | β− (93.96%) | 14C | 2− | ||
| β−, n (6.04%) | 13C | ||||||||
| 15B | 5 | 10 | 15.031103(24) | 9.87(7) мс | β−, n (93.6%) | 14C | 3⁄2− | ||
| β− (6.0%) | 15C | ||||||||
| β−, 2n (0.40%) | 13C | ||||||||
| 16B | 5 | 11 | 16.03981(6) | <190×10−12 с [<0.1 MeV] |
n | 15B | 0− | ||
| 17B[n 5] | 5 | 12 | 17.04699(18) | 5.08(5) мс | β−, n (63.0%) | 16C | (3⁄2−) | ||
| β− (22.1%) | 17C | ||||||||
| β−, 2n (11.0%) | 15C | ||||||||
| β−, 3n (3.5%) | 14C | ||||||||
| β−, 4n (0.40%) | 13C | ||||||||
| 18B | 5 | 13 | 18.05617(86)# | <26 нс | n | 17B | (4−)# | ||
| 19B[n 5] | 5 | 14 | 19.06373(43)# | 2.92(13) мс | β− | 19C | (3⁄2−)# | ||
- В свою чергу розпадається до 4He з подвійний випусканням протона, в результаті реакції 7B → 4He + 3Шаблон:Hsp1H
- Має 1 протон гало
- одразу ж розпадається на дві α-частинки, в результаті реакції 9B → 2 4He + 1H
- Одразу ж розпадається на дві α-частинки, в результаті реакції 12B → 3Шаблон:Hsp4He + e-
- Має 2 нейтрони гало
Нотатки
- Поширеність ізотопів наведена для більшості природних земних взірців. Для інших джерел значення можуть сильно відрізнятися.
- Комерційно доступні матеріали можуть підлягати прихованому або випадковому розділенню на ізотопи. Можуть траплятись суттєві відхилення від поданої маси і складу.
- Оцінки позначені # отримані не з чисто експериментальних даних, але частково із систематичних трендів у сусідніх нуклідів (з такими самими відношеннями Z і N). Спіни зі слабким оцінковим обґрунтуванням взяті в дужки.
- похибку вимірювання подано в скороченій формі в дужках після відповідних останніх цифр. Похибка позначає одне стандартне відхилення, за винятком ізотопної поширеності та атомної маси від IUPAC, яка використовує складніші визначення похибок[4]. Приклади: 29770,6(5) означає 29770,6 ± 0,5; 21,48(15) означає 21,48 ± 0,15; −2200,2(18) означає −2200,2 ± 1,8.
- Маси радіонуклідів подані за даними Комісії з символів, одиниць, номенклатури, атомних мас і фундаментальних констант (SUNAMCO) IUPAP.
- Поширеності ізотопів подані за даними Комісії з ізотопних поширеностей і атомних мас IUPAC.
Застосування
Бор-10
Бор-10 застосовують у борній нейтрон-захоплювальній терапії (BNCT) як експериментальний метод лікування деяких злоякісних пухлин мозку.
Примітки
- В. В. Громов. Разделение и использование стабильных изотопов бора. — Москва : ВИНИТИ, 1990.(рос.)
- Рисованый В.Д., Захаров А.В. и др. Бор в ядерной технике. — 2-е, перераб. и доп. — Димитровград : ОАО "ГНЦ НИИАР", 2011. — 668 с.(рос.)
- Universal Nuclide Chart. nucleonica.
- 2.5.7. Standard and expanded uncertainties. Engineering Statistics Handbook. Процитовано 16 вересня 2010.
Джерела
- Маси ізотопів взяті з:
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- Кількісні співвідношення ізотопів і стандартні атомні маси взяті з:
- J. R. de Laeter; J. K. Böhlke; P. De Bièvre; H. Hidaka; H. S. Peiser; K. J. R. Rosman; P. D. P. Taylor (2003). Atomic weights of the елементs. Review 2000 (IUPAC Technical Report). Pure and Applied Chemistry 75 (6): 683–800. doi:10.1351/pac200375060683.
- M. E. Wieser (2006). Atomic weights of the елементs 2005 (IUPAC Technical Report). Pure and Applied Chemistry 78 (11): 2051–2066. doi:10.1351/pac200678112051. Загальний огляд.
- Період напіврозпаду, спін, і дані ізомерів взяті з:
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- National Nuclear Data Center. NuDat 2.1 database. Brookhaven National Laboratory. Процитовано September 2005.
- N. E. Holden (2004). Table of the Ізотопи. У D. R. Lide. CRC Handbook of Chemistry and Physics (вид. 85th). CRC Press. Section 11. ISBN 978-0-8493-0485-9.
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
