Берилій
Бери́лій (хімічний символ — Be, лат. Beryllium) — хімічний елемент з атомним номером 4, який належить до 2-ї групи (за старою класифікацією — головної підгрупи II групи), 2-го періоду періодичної системи хімічних елементів, та є першим представником лужноземельних металів.
| 4 | Берилій |
9,012 | |
| 2s2 | |
Також бери́лієм називають просту речовину хімічного елемента Берилію. За нормальних умов) це легкий, твердий, крихкий, сріблясто-сірий, хімічно активний метал.
Представлений Берилій лише одним стабільним ізотопом 9Be. При нагріванні сполучається з киснем, галогенами та іншими неметалами. Розчинний в лугах і більшості кислот. При високих температурах взаємодіє з більшістю металів, утворюючи бериліди. Леткі сполуки берилію та пил, що містить берилій, токсичні. Відомо 54 берилієві мінерали, найважливіші — берил, фенакіт, бертрандит, гельвін, крім того, берилій міститься у мінералі: бабефіт.
Історія

Мінерали, що містять берилій (дорогоцінні камені), — берили (смарагд, аквамарин тощо) — відомі з глибокої давнини. Деякі з них добувалися на Синайському півострові ще в XVII столітті до нашої ери. У Стокгольмському папірусі (III століття) описуються способи виготовлення підроблених каменів. Назва «берил» (Beryll) зустрічається у грецьких і латинських античних письменників і в давньоруських творах, наприклад в "Изборник Святослава" 1073 року, де берил фігурує під назвою «віруліон».
Відкриття
Дослідження хімічного складу дорогоцінних мінералів цієї групи почалося лише в кінці XVIII століття з настанням хіміко-аналітичного періоду. В той час мінерал берил був відомий багатьом хімікам XVIII століття. Перші аналізи (Клапрот, Біндгейм тощо) не виявили в берилі нічого особливого. В кінці XVIII століття відомий мінералог абат Рене-Жюст Аюї звернув увагу на повну схожість кристалічної будови берилу з Ліможу та смарагду з Перу.
Берилій був відкритий в 1797 році французьким хіміком Луї Нікола Вокленом у вигляді берилієової землі (оксиду ВеО), а саме тоді, коли займаючись порівняльним аналізом та з'ясовуванням загальних особливостей хімічного складу двох дорогоцінних каменів берилу і смарагду, отриманих від Рене-Жюст Аюї, він виявив присутність оксиду невідомого хімічного елемента. Той був схожий на оксид алюмінію (глинозем), проте мав деякі відмінності. Оксид розчинявся у вуглекислому амонії (оксид алюмінію такою властивістю не володів), сірчанокисла сіль даного елементу не утворювала галунів з сірчанокислим калієм (а сірчанокисла сіль алюмінію такі галуни утворює). Використовуючи різницю у властивостях оксидів Воклен розділив оксид алюмінію та оксид невідомого елемента.
Після того, як оксид був отриманий, тривалий час не вдавалося виділити чистий берилій. Лише через три десятиліття, в 1828 році Велер Фрідріх в Німеччині і незалежно від нього Антуан Олександр Брут Бюссі у Франції отримали порошокоподібний металевий берилій, методом взаємодії металевого калію на хлорид берилію, правда в дуже невеликих кількостях:
Проте внаслідок наявності великої кількості домішок його не вдавалося виплавити. І врешті решт майже через 70 років у 1898 році французький хімік П. Лебо, піддавши електролізу берилієво-фтористий натрій, отримав достатньо чисті металеві кристали берилію[5].
Істотна подібність берилію з алюмінієм принесла багато клопотів і Дмитру Івановичу Менделєєву, який відкрив періодичний закон. Саме через цю подібність в середині XIX століття берилій вважали тривалентним елементом з атомною вагою 13,8. З цими властивостями він повинен був знаходиться між вуглецем і азотом, що геть руйнувало закономірності періодичного закону. Однак Менделєєв був впевнений в правильності відкритої ним закономірності і доводив, що атомна маса берилію визначена не правильно, і що берилій повинен бути не тривалентним, а двовалентним елементом «з магнезіальними властивостями». Виходячи з цього, Менделєєв помістив берилій у другу групу періодичної системи разом з двовалентними лужноземельними металами, виправивши його атомну вагу на 9. Д. І. Менделєєв писав з цього приводу:
«...Непорозуміння тривало кілька років. Не раз мені доводилося чути про те, що питання по атомній вазі берилію загрожує сколихнути загальність періодичного закону, може вимагати в ньому глибоких перетворень. У науковій суперечці, що стосується берилію, взяли участь чималі сили, звичайно, тому саме, що справа йшла про предмет більш багатозначний, ніж атомність порівняно рідкісного елемента; періодичний закон роз'яснювався в цих суперечках, і взаємний зв'язок елементів різних груп став більш очевидним, ніж було коли-небудь...»
Довгий час головними противниками двовалентності берилію були шведські хіміки професора Ларс Фредрік Нільсон і Отто Петерсон. У 1878 році вони опублікували статтю «Про отримання і валентність берилію», наприкінці якої були такі слова:
«...наша думка про істинну атомну вагу і хімічну природу цього металу суперечить так званому періодичному закону, який Менделєєв прирівняв для всіх елементів, а саме не тільки тому, що при ат. масі Be = 13,8 цей метал навряд чи може бути поміщений в систему Менделєєва, але й тому, що тоді елемент з атомною вагою 9,2, як це вимагає періодичний закон, в системі був відсутній і, напевно, ще має бути відкритий...»
Перше підтвердження своїх поглядів Менделєєв знайшов в одній з маловідомих робіт російського хіміка І. В. Авдєєва (1842), який відносно точно приписував берилію атомну масу 9,26 (сучасна 9,0122), та вважав, що оксид берилію хімічно подібний оксиду магнію. Також на захист періодичного закону виступив чеський хімік Богуслав Браунер, який вважав, що відомий Закон Дюлонга — Пті, яким користувалися шведські хіміки, має деякі відступи в області малих атомних мас, до якої власне і відноситься берилій. Крім того, Браунер радив Нільсону і Петерсону визначити густину парів хлористого берилію, вважаючи, що кількісне визначення цієї характеристики допоможе точно встановити приналежність елемента до тієї чи іншої групи періодичної системи. І коли наприкінці 70-х років XIX століття ці ж шведські хіміки (колись найбільш затяті прихильники думки про тривалентний берилій) повторили свої досліди і виконали те, що радив їм Браунер (повторно визначивши атомну вагу берилію, знайшли її рівною 9,1), вони переконалися у правоті Менделєєва. В статті, що відображала результати цієї роботи, Нільсон і Петерсон написали:
«...ми повинні відмовитися від раніше підтримуваної нами думки про те, що берилій тривалентний елемент ... Одночасно ми визнаємо правильність періодичного закону і в цьому важливому випадку...»
У 1884 році Нільсон писав Менделєєву:
«...не можу не висловити Вам мого сердечного вітання з приводу того, що і в цьому випадку, як і в багатьох інших, система виправдала себе...»
Пізніше в одному з видань «Основ хімії» Д.І. Менделєєв зазначив, що «Нільсон і Петерсон — одні з головних захисників тривалентного берилію ... самі ж і пред'явили дослідні докази на користь його двовалентності».
Так берилій, колись перший камінь спотикання на шляху періодичного закону, тільки підтвердив його загальність. Завдяки періодичному закону стало більш чітким поняття щодо фізичної і хімічної сутності берилію. Образно кажучи, берилій отримав, нарешті, свій «паспорт».
З берилієм пов'язано таке відкриття як «нейтрон». А саме коли на початку 30-х років німецькі фізики Вальтер Боте і його студент Герберт Бекер, бомбардуючи берилій альфа частинками, помітили так зване «берилієве випромінювання» — дуже слабке, але надзвичайно проникаюче. Воно, як було доведено пізніше, виявилося потоком нейтронів. А ще пізніше ця властивість берилію лягла в основу «нейтронних гармат» — джерел нейтронів, що застосовуються в різних областях науки і техніки. Так було покладено початок вивченню атомної структури берилію.
Застосування берилію почалося в 40-х роках XX століття, хоча його цінні властивості як компонента сплавів були виявлені ще раніше, а чудові ядерні - на початку 30-х років того ж століття.
Походження назви
Після того як Воклен в 1897 році відкрив берилієву землю, він опублікував роботу в науковому журналі «Annales de chimie», редактор якого, запропонував для неї назву «гліцина» від грец. γλυμυς — солодка, через те що її деякі солі, які отримав Воклен під час своїх дослідів, мали солодкий смак. Новий елемент, що міститься в цій землі, відповідно було названо «глюциній» (Glucinium).
Але хіміки Мартін Генріх Клапрот та Андерс Густав Екеберг, будучи противниками найменування нових елементів за випадковими властивостями їх сполук, та маючи вплив у науковому середовищі, порахували, що дана назва невдала, мотивуючи тим що солодким смаком володіють сполуки й інших елементів (наприклад солі ітрію), і у їхніх роботах «земля», відкрита Вокленом, називається берилієвою, а відповідно хімічний елемент має назву «берилій» (Beryllium).
Сучасна назва «берилій» походить від назви напівдорогоцінних каменів берилів (грец. βήρυλλος), назва яких у свою чергу походить ймовірно зі слова на санскриті «वैडूर्य» (vaidurya), яке і свою чергу походить від назви сучасного міста Белур (Веллуру) що в Південній Індії, неподалік Мадраса, де з давніх часів були відомі родовища берилів (а саме смарагдів).
Тим не менш, в науковій літературі XIX століття, Аж до 60-х років, берилій часто-густо називається «гліцієм», «гліцинієм» або «глюцинієм» (і супроводжується хімічним символом "Gl"). Нині ця назва зберіглася тільки у Франції.
Цікаво відзначити, що з пропозицією називати елемент-№4 берилієм ще в 1814 році виступав харківський професор Федір Іванович Гізе.
Поширення


Типово рідкісний літофільний елемент. Середній вміст берилію в земній корі складає 3.8 г/т (2,6×10–4 % за масою), в морській воді 6×10-7 мг/л (надзвичайно низький)[6]. Його присутність збільшується від ультраосновних (0,2 г/т) до кислих (5 г/т) та лужним (70 г/т) породам. Зазвичай берилій зустрічається як незначна домішка в різних мінералах земної кори. Основна маса берилію в магматичних породах пов'язана з плагіоклазами, де берилій заміщає кремній. Проте найбільші його концентрації характерні для деяких темнокольорових мінералів і мусковіту (десятки, рідше сотні г/т). У лужних пегматитах берилій встановлюється в невеликих кількостях у складі рідкісних мінералів: евдидиміту, чкаловіту, анальциму і лейкофану, де він входить в аніону групу. І все ж, якщо в лужних породах берилій майже повністю розсіюється, то при формуванні кислих гірських порід він може накопичуватися в постмагматичних продуктах — пегматитах та пневматоліто гідротермальних родовищах (тобто родовищах, що утворилися в результаті взаємодії високотемпературних парів і розчинів з певними типами гірських порід). Постмагматичні розчини виносять берилій з магми у вигляді фторвмісних еманацій і комплексних сполук в асоціації з вольфрамом, оловом, молібденом і літієм. У кислих пегматитах утворення значних скупчень берилію пов'язано з процесами альбітизації і мусковітизації.
І лише незначна частина земного берилію сконцентрована у власних берилієвих мінералах. Їх відомо більше 50 (точніше поки 54), але тільки шість з них вважаються більш-менш поширеними (берил, хризоберил, бертрандит, фенакіт, гельвін, даналіт). Берилій утворює власні мінерали також і у пегматитах, але частина його (бл. 10%) знаходиться в ізоморфній формі в породотвірних і другорядних мінералах (мікрокліні, альбіті, кварці, слюдах, та ін.). А серйозне промислове значення набув поки тільки один берил, відомий людині з глибокої давнини. Берили зустрічаються в гранітних пегматитах, наявних майже у всіх країнах земної кулі. Це красиві, в основному зеленуваті кристали, що досягають іноді дуже великих розмірів. Відомі берили-гіганти вагою до тони і завдовжки до 9 метрів. Деякі різновиди берилу вважаються дорогоцінним камінням: аквамарин — блакитний, зеленувато-блакитний; смарагд — густо-зелений, яскраво-зелений; геліодор — жовтий. Відомі ряд інших різновидів берилу, що розрізняються забарвленням (темно-сині, рожеві, червоні, блідо-блакитні, безбарвні та ін.), всі вони мають подібний хімічний склад — Be3Al2(SiO3)6, а колір їм надають домішки різних елементів. Наразі їх навчилися синтезувати штучно.
Ізотопи
Представниками природних ізотопів берилію є: єдиний стабільний ізотоп 9Be (поширеність ~100%); та двоє радіоактивних 10Be (Т1⁄2 — 1.36×106 років) і 7Be (Т1⁄2 — 53.12 діб).
Багато вчених вважають, що на Землі ізотопи берилію 10Ве і 7Be утворюються не в надрах, а в атмосфері — в результаті впливу космічних променів на ядра азоту і кисню. Незначні домішки цих ізотопів виявлені в дощі, снігу, повітрі, в метеоритах і морських від кладеннях. Атоми ізотопу 10Be (період напіврозпаду близько 1,4 млн років) народжуючись в атмосфері, на висоті приблизно 25 км, разом з опадами потрапляють в океан і осідають на дні. Берилій-10 акумулюється у морських мулах і викопних кістках (кістки сорбують берилій з природних вод). Прогнозують якщо зібрати воєдино весь 10Ве, що знаходиться в атмосфері, водних басейнах, ґрунті і на дні океану, то вийде досить значна цифра — близько 800 т. Життя іншого радіоізотопу — берилію-7 — значно коротше: його період напіврозпаду дорівнює всього 53 дням. Тому не дивно, що кількість його на Землі вимірюється грамами. Ізотоп 7Be може бути отриманий і в циклотроні, але це дорого обійдеться. Окрім цих відомі ще 9 радіоактивних ізотопів берилію з масовими числами від 5Be до 16Be.
Цікаво, що берилій — єдиний елемент періодичної системи, що має при парному номері всього один стабільний ізотоп.
Фізичні властивості
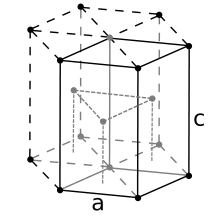
Берилій — легкий (в півтора рази легше алюмінію), твердий (один із найтвердіших металів у чистому вигляді (5,5 балів за Моосом) (поступається тільки іридію, осмію, вольфраму і урану) (їм можна різати скло)), відносно міцний (модуль пружності — 300 ГПа (у сталей — 200—210 ГПа)), але водночас немало крихкий (ударна в'язкість 10—50 кДж⁄м2 (0,1—0,5 кгс·м⁄см2)) метал сріблясто-сірого кольору. В берилії дуже добре поширюються звукові хвилі — 12 600 м⁄с, що в 2—3 рази більше, ніж в інших металах. До температури 1277 °C існує стійкий α-Ве (гексагональна-щільноупакована ґратка з параметрами а = 0,22855 нм, с = 0,35833 нм), а при температурах, що передують плавленню металу (1277-1287 °C) переходить в β-Be з кубічною ґраткою. Берилій володіє найвищою зі всіх металів теплоємністю, 1,80 кДж⁄(кг·К) (0,43 ккал⁄(кг·°С)), високою теплопровідністю, 178 Вт⁄(м·К) (0,45 кал⁄(см·сек·°С)) при 50 °С, низьким електроопором, 3,6—4,5 мком·см при 20 °С; коефіцієнт лінійного розширення 10,3—131 (25—100 °С); межа міцності берилію при розтягуванні 200—550 Мн⁄м2 (20-55 кгс⁄мм2), подовження 0,2-2%. Ці властивості залежать від якості і структури металу і помітно змінюються з температурою. Механічні властивості берилію залежать від чистоти металу, величини зерна і текстури, яка визначається характером обробки. Обробка тиском приводить до певної орієнтації кристалів берилію, виникає анізотропія, і стає можливе поліпшення властивостей. При цьому межа міцності у напрямі витяжки доходить до 400—800 Мн⁄м2 (40—80 кгс⁄мм2), межа плинності 250—600 Мн⁄м2 (25-60 кгс⁄мм2), а відносне подовження до 4—12 %. Механічні властивості в напрямку, перпендикулярному витяжці, майже не змінюються. Температура переходу берилію з крихкого стану в пластичний 200—400 °С. Виходить що берилій володіє одночасно і легкістю, і міцністю, і теплостійкістю.
З'ясовано, що його відрізняє малий перетин захоплення нейтронів і великий перетин їх розсіювання. Іншими словами, берилій (а також його окис) розсіює нейтрони, змінює напрямок їх руху і уповільнює їх швидкість до таких величин, при яких ланцюгова реакція може протікати більш ефективно. На всіх цих властивостях ґрунтується застосування берилію в атомній техніці — він один із найнеобхідніших їй елементів.
Хімічні властивості
Берилій — типовий амфотерний елемент (тобто має властивості і металу, і неметалу, однак металічні все ж переважають), в хімічних сполуках характерна тільки одна ступінь окиснення +2 (конфігурація зовнішніх електронів 2s2), та володіє високою хімічною активністю. За багатьма хімічними властивостями берилій більше схожий на алюміній, ніж на магній, що знаходиться безпосередньо під ним (прояв «діагональної подібності»).
Водночас металічний берилій при кімнатній температурі відносно мало реакційно здатний (компактний берилій дуже стійкий проти корозії), і тому при кімнатній температурі берилій реагує помітно тільки з фтором, а при невеличкому нагріванні і з хлором, утворюючи фторид та хлорид відповідно:
Він, як і алюміній, покривається при взаємодії з повітрям тонкою та міцною оксидною (ВеО) плівкою, що захищає метал від дії кисню навіть при високих температурах (пасивація). Лише за порогом 600 °C починає швидко окислюватися, а при температурі 1200 °C металічний берилій згоряє яскравим полум'ям, перетворюючись у оксид BeO (білий порошок) та нітрид Be3N2:
Теж саме стосується і води, з якою та водяною парою берилій у компактному вигляді завдяки оксидній плівці не реагує навіть при температурі червоного розжарювання, хоча знаходиться в ряду стандартних потенціалів значно лівіше водню, з яким берилій також практично не реагує навіть при нагріванні до 1000 °C. Через це гідрид берилію (полімер, стійкий до 240 °С) доводиться отримувати непрямим шляхом, наприклад при розкладанні берилій органічних сполук, чи наприклад за реакцією (проведеної в ефірному розчині):
Відповідний гідроксид Be(OH)2 — полімерна, нерозчинна у воді, амфотерна сполука, причому як основні (з утворенням Be2+), так і кислотні (з утворенням [Be(OH)4]2-) властивості виражені слабо:
Дією на гідроксид берилію розчинами карбонових кислот або при упарюванні розчинів їх берилієвих солей отримують оксисолі берилію, наприклад, оксиацетат Be4O(CH3COO)6. Ці сполуки містять тетраедричне угруповання Be4O, по шести ребрах цього тетраедру розташовуються ацетатні групи. Такі сполуки відіграють велику роль у процесах очищення берилію, так як вони не розчиняються у воді, але добре розчиняються в органічних розчинниках і легко сублімується у вакуумі.
Вище 600 °C берилій реагує з іншими галогенами та сірководнем, взаємодіє з азотом при температурі вище 650 °С та аміаком при вище 1200 °C, з якими утворює нітрид Be3N2, а при температурі вище 1700 °С з вуглецем, утворюючи карбід Ве2С:
Мілкодисперсний порошок берилію може згоряти в парах сірки, селену, телуру:
Всі ці реакції супроводжуються виділенням великої кількості теплоти, так як міцність кристалічних ґраток виникаючих сполук (BeO, BeS, Be3N2, ВеСl2 та ін.) доволі велика. При високих температурах берилій взаємодіє з більшістю металів, утворюючи бериліди, з алюмінієм і кремнієм дає евтектичні сплави.
Берилій легко розчиняється плавиковою, соляною, розбавленою сірчаною кислотами, слабо реагує з концентрованою сірчаною і розведеною азотною кислотами і як це не дивно, не реагує з концентрованою азотною (від неї як і від кисню, берилій захищений окисидною плівкою (пасивація)):
Реакція берилію з водними розчинами лугів супроводжується виділенням водню і утворенням гідроксоберилатів:
При проведенні реакції з розплавами лугів при 400-500 °C утворюються солі-берилати (діоксоберилати), подібні алюмінатам (багато з яких мають солодкуватий смак (завдяки іонам [Be(OH)4]2- та [Be(OH2)4]2+, що утворюються під час гідролізу), але куштувати на смак їх не можна — майже всі берилати отруйні):
Солі берилію сильно гігроскопічні і за невеликим винятком (фосфат, карбонат) добре розчиняються у воді, їх водні розчини внаслідок гідролізу мають кислу реакцію. У більшості сполук берилій проявляє координаційне число 4. Так, у структурі твердого BeCl2 є ланцюжки з містковими атомами хлору. За рахунок утворення міцних тетраедричних аніонів багато сполук берилію вступають у реакції з солями інших металів. Наприклад фторид BeF2 з фторидами лужних металів і амонію утворює фторберилати (які мають велике промислове значення) (наприклад K2BeF4):
Розчинність домішкових елементів в берилії надзвичайно мала. Розплавлений берилій дуже реакційноздатний, він взаємодіє з більшістю оксидів, нітридів, сульфідів і карбідів. І тому поки єдино придатним матеріалом на тиглі для плавки берилію слугує оксид берилію. Окис берилію (BeO) володіє і іншими цінними властивостями і в деяких випадках конкурує з самим берилієм. Відомий ряд складних берилій органічних сполук, гідроліз і окислення деяких з них протікають з вибухом. Деякі сполуки берилію служать каталізаторами хімічних реакцій.
Отримання
Добування берилію з його природних мінералів (в основному берилу) включає декілька стадій, при цьому особливо важливо відокремити берилій від схожого за властивостями і супутнього берилію в мінералах — алюмінію.
Основним методом виробництва берилію є відновлення його фториду металевим магнієм при 900—1300 °С:
При цьому фторид отримують з гідроксиду, а гідроксид з берилієвого концентрату. Вже перший прогін цих технологічних сходів складається з декількох ступенів: концентрат піддають термообробці, подрібненню, потім на нього послідовно діють сірчаною кислотою, водою, розчинами аміаку і їдкого натру, спеціальними комплексно утворювачами. Одержаний берилат натрію гідролізують, і на центрифузі відокремлюють гідроокис. Гідроокис перетворюється на фторид теж лише після кількох операцій, кожна з яких досить складна і трудомістка. Відновлення магнієм йде при температурі 900 °C, хід процесу ретельно контролюється. Важлива деталь: тепло, що виділяється в реакції, поглинається з тією ж швидкістю, що і виділяється. Отриманий рідкий метал виливають у графітові виливниці, але він забруднений шлаком, і тому його ще раз переплавляють у вакуумі.
За іншим методом можна також, наприклад, сплавити берил з гексафторосилікатом натрію Na2SiF6:
В результаті сплаву утворюються кріоліт Na3AlF6 — погано розчинна у воді сполука, а також розчинний у воді флуороберилат натрію Na2[BeF4]. Його далі вилуговують водою. Для глибшого очищення берилію від алюмінію застосовують обробку отриманого розчину, карбонатом амонію (NH4)2CO3. При цьому алюміній осідає у вигляді гідроксиду Al(OH)3, а берилій залишається в розчині у вигляді розчинного комплексу (NH4)2[Be(CO3)2]. Цей комплекс потім розкладають до оксиду берилію ВеО при прожаренні:
Інший метод очищення берилію від алюмінію базується на тому, що оксиацетат берилію Be4O(CH3COO)6, на відміну від оксиацетату алюмінію [Al3O(CH3COO]+CH3COO−, має молекулярну будову і легко сублімується при нагріванні.
Відомий також спосіб переробки берилу, в якому спочатку берил обробляють концентрованою сірчаною кислотою при температурі 300 °C, а потім сплав вилуговують водою. Сульфати алюмінію і берилію при цьому переходять в розчин. Після додавання до розчину сульфату калію K2SO4 алюміній видаляють з розчину у вигляді алюмокалієвого галуну KAl(SO4)2·12H2O. Подальше очищення берилію від алюмінію проводять так само, як і в попередньому методі.
Існує й такий спосіб переробки берилу. Роздрібнений берил змішують з вуглецем (сажею) і прожарюють у струмені хлору (при цьому леткі хлориди кремнію та алюмінію вилітають, а берилію хлорид залишається):
Нарешті, відомий і такий спосіб переробки берилу. Вихідний мінерал спочатку сплавляють з поташем K2CO3. При цьому утворюються берилат K2BeO2 і алюмінат калію KAlO2:
Після вилуговування водою отриманий розчин підкислюють сірчаною кислотою. В результаті в осад випадає кремнієва кислота. З фільтрату далі вилучають алюмокалієвий галун, після чого в розчині з катіонів залишаються тільки іони Ве2+.
З отриманого тим або іншим способом оксиду берилію ВеО потім отримують флуорид, з якого магнійтермічним методом відновлюють металевий берилій:
Металевий берилій можна отримати також електролізом розплаву BeCl2 і NaCl при температурах близько 350 °C. Вихідні солі берилію виділяють при переробці берилієвої руди. Отриманий метал переплавляють у вакуумі.
Металевий берилій надвисокої чистоти (необхідний для новітньої техніки й особливо для ядерної енергетики) отримують різними методами. Найосновніші з них: дистиляція у вакуумі, зонне плавлення в електронно-променевих печах, анодне (електролітичне) рафінування.
Через труднощі одержання якісних виливків, заготовки для виробів з берилію готують методами порошкової металургії. Берилій подрібнюють в порошок і піддають гарячому пресуванню у вакуумі при 1140—1180 °С. Прутки, труби та інші профілі отримують витискуванням при 800—1050 °С (гаряче витискування) або при 400—500 °С (тепле витискування). Листи з берилію отримують прокаткою гарячепресованих заготовок або видавлених смуг при 760—840 °С. Застосовують і інші види обробки — кування, штампування, волочіння. При механічній обробці берилію користуються твердосплавним інструментом.
У вигляді простої речовини в XIX столітті берилій отримували дією калію на безводний хлорид берилію:
А трохи пізніше — електролізом розплаву флуороберилату барію Ba[BeF4]:
Застосування
Широке виробництво чистого берилію почалося після 2-ї світової війни. Завдяки поєднанню його цінних властивостей, іноді, здавалося б протилежно взаємовиключних, він знайшов застосування у багатьох напрямах:
Металургія

- Берилій додається до багатьох сплавів, бо легко утворює сплави з багатьма металами, надаючи їм більшу твердість, міцність, жаротривкість та корозієстійкість. Добавки берилію облагороджують сплави на основі алюмінію і магнію. Лише невеличкі кількості берилію (досить 0,005%) набагато зменшують втрати магнієвих сплавів від горіння і окиснення при плавці і литті. Одночасно поліпшується якість виливків, значно спрощується технологія тощо.
- Окрім як вводячи берилій в ті чи інші сплави, для запобігання швидкого зносу деталей, їх іноді берилізують — насичують їх поверхню берилієм шляхом дифузії. Робиться це так: сталеву деталь опускають у берилієвий порошок і витримують у ньому при 900—1100 °C протягом 10—15 годин. Поверхня деталі покривається твердою хімічною сполукою берилію з залізом і вуглецем. Цей міцний панцир товщиною всього 0,15—0,4 мм надає деталям жаростійкість і стійкість до морської води і азотної кислоти.
 |
 |
- Берилієва бронза — один зі сплавів берилію — це матеріал, що дозволив вирішити багато складних технічних завдань. З неї роблять пружини, ресори, амортизатори, підшипники, шестерні і багато інших виробів, від яких потрібні велика міцність, хороша опірність втомі і корозії, збереження пружності в широкому інтервалі температур, високі електро та теплопровідні характеристики. Берилієвими бронзами називають сплави міді з 0,2—4 % берилієм. На відміну від чистого берилію вони добре піддаються механічній обробці, з них можна, наприклад, виготовити стрічки товщиною всього 0,1 мм. Розривна міцність цієї бронзи більша, ніж у багатьох легованих сталей. Ще одна примітна деталь: з плином часу більшість матеріалів, в тому числі і метали, «втомлюються» і втрачають міцність. Берилієві бронзи — навпаки. При старінні їхня міцність зростає. Вони немагнітні. Крім того, вони не іскрять при ударі.
- Оксид берилію застосовується як дуже важливий вогнетривкий матеріал (вважається одним з найкращих вогнетривких матеріалів) в спеціальних випадках. Висока тугоплавкість (температура плавлення 2570 °C), значна хімічна стійкість і велика теплопровідність (найтеплопровідніший з усіх оксидів) якого, дозволяють застосовувати його в багатьох галузях техніки, зокрема для футерування безсердечникових індукційних печей і тиглів для плавки різних металів та сплавів. Цікаво, що окис берилію абсолютно інертний по відношенню до металевого берилію, і тому є поки єдиним матеріалом, з якого виготовляють тиглі для плавки берилію у вакуумі.
- Галогеніди а саме фторид і хлорид берилію використовуються і мають велике значення в процесі переробки берилієвих руд.
Авіаційна та аерокосмічна техніка
- Одним із споживачів берилієвої бронзи є авіаційна промисловість. Стверджують, що в сучасному важкому літаку налічується більше тисячі деталей з берилієвої бронзи. У виробництві гальм для аерокосмічної техніки, теплових екранів і систем наведення з нею не може конкурувати практично жоден конструкційний матеріал.
- Бериліди (інтерметалічні сполуки берилію з танталом, ніобієм, цирконієм та іншими тугоплавкими металами) застосовуються як конструкційні матеріали для двигунів і обшивки ракет та літаків, а також в атомній техніці, бо мають виняткову твердість і стійкість проти окислення, а найкращою технічною характеристикою берилідів слугує той факт, що вони можуть пропрацювати більше 10 годин при температурі 1650 °C.
- Велика теплопровідність (в 4 рази вище, ніж у сталі), велика теплоємність і жаростійкість дозволяють використовувати сплави берилію в теплозахисних конструкціях космічних кораблів. Так наприклад, з берилію був зроблений зовнішній тепловий захист капсули космічного кораблю «Френдшип-7», на якому Джон Гленн першим з американських космонавтів здійснив (після Юрія Гагаріна і Германа Титова) орбітальний політ.
- Зокрема, завдяки здатності зберігати високу точність і стабільність розмірів берилієві деталі використовують в гіроскопах — приладах, що входять в систему орієнтації та стабілізації ракет, космічних кораблів і штучних супутників Землі.

Ядерна енергетика
- Поєднання малого перетину захоплення теплових нейтронів (0,009 барн на атом), малої атомної маси і задовільної стійкості в умовах радіації що зберігається і при дуже високій температурі, робить берилій одним з найкращих матеріалів для виготовлення сповільнювачів (з усіх твердих матеріалів берилій вважається найкращим сповільнювачем нейтронів) і відбивачів нейтронів (що дозволяє міняти їх напрямок, повертати нейтрони в активну зону реактора, протидіяти їх витоку) в атомних реакторах. Це використання дозволяє набагато зменшити розміри активної зони реакторів, збільшити робочу температуру і ефективніше використовувати ядерне паливо. Тому, незважаючи на високу вартість берилію, його використання вважають економічно виправданим, особливо в невеликих енергетичних реакторах для літаків і морських суден.
- Також матеріалом для сповільнювачів та відбивачів нейтронів може слугувати оксид берилію, в деяких напрямах як більш ефективний, ніж чистий берилій.
- Оксид берилію став важливим матеріалом для виготовлення оболонок тепловиділяючих елементів (твелів) атомних реакторів. У твелах особливо велика щільність нейтронного потоку, в них — найвища температура, найбільші напруги і всі умови для корозії. Оскільки уран корозійно нестійкий і недостатньо міцний, його доводиться захищати спеціальними оболонками, як правило, з BeO.
- Також оксид берилію в суміші з окисом урану застосовується як дуже ефективне ядерне пальне.
- Берилій-9 у сумішах із деякими α-радіоактивними нуклідами використовують у ампульних нейтронних джерелах, так як при взаємодії ядер берилію-9 і α-частинок виникають нейтрони:
- Сплав фториду берилію з фторидом літію застосовується як теплоносій і розчинник солей урану, плутонію, торію у високотемпературних рідиносольових атомних реакторах.
- Фторид берилію використовується в атомній техніці для зварювання скла, вживаного для регулювання невеликих потоків нейтронів. Найтехнологічніший і якісний склад такого скла — (BeF2 — 60%, PuF4 — 4%, AlF3 — 10%, MgF2 — 10%, CaF2 — 16%).
Рентгенотехніка

- Завдяки малій атомній вазі берилій пропускає в 17 разів більше м'яких рентгенівських променів, ніж алюміній такої ж товщини, тобто небажане поглинання випромінювання набагато менше, і тому з нього виготовляють віконця рентгенівських трубок (через які випромінювання виходить назовні) і віконця рентгенівських та широкодіапазонних гама-детекторів, через які випромінювання проникає в детектор.
Електроніка
- Кераміка на основі окису берилію стала матеріалом корпусів так званих ламп біжної хвилі — дуже ефективних радіоламп, що не втратили свого значення навіть під потужним натиском напівпровідників.
Оптичні прилади
- Знайшов застосування і алюмінат берилію, з якого виготовляють твердотільні випромінювачі (стрижні, пластини) для лазерної техніки.
- За допомогою окису берилію створюють спеціальні типи скла, що мають велику прозорість для ультрафіолетових і інфрачервоних променів.
- Берилієві дзеркала становлять особливий інтерес. Велика площа дзеркал, часто зі стільниковою структурою підтримки, які використовуються, наприклад, у метеорологічних супутниках, де мала вага і довгострокова стабільність розмірів мають вирішальне значення. Менші берилієві дзеркала використовують в оптичних системах наведення і управління вогнем, наприклад, у бойових танках німецького виробництва Leopard 1 і Leopard 2.
Вибухові речовини
- Оксиліквіт на основі берилію — одна з найпотужніших вибухових речовин, відомих на сьогоднішній день. Може застосовується при вибухових роботах в гірничій справі.
Різне
- З нікель-берилієвих сплавів (вміст Be не перевищує 1,5%) виготовляють хірургічні інструменти, голки для підшкірних ін'єкцій, литі зубні імплантати.
- Зі сплаву «елінвар» (нікель, берилій, вольфрам) у Швейцарії роблять пружини для годинників.
- Мідно-берилієвий сплав в США використовують для виготовлення втулок пишучого механізму кулькових ручок.
- Берилій-7 використовують іноді для прогнозування погоди. Він виконує роль своєрідної «мітки» повітряних шарів: спостерігаючи зміну концентрації 7Ве, можна визначити проміжок часу від початку руху повітряних мас. Ще рідше застосовують 7Be в інших дослідженнях: хіміки — як радіоактивний індикатор; біологи — для вивчення можливостей боротьби з токсичністю самого берилію.
- Ізотоп Берилій-10 становить винятковий інтерес для геохімії та ядерної метеорології. А саме знаючи концентрацію 10Ве у взятій з дна пробі і період напіврозпаду цього ізотопу, можна обчислити вік будь-якого шару на дні океану. У зв'язку з цим виникло припущення про можливість визначення віку органічних залишків по 10Be. Тим саме справа ще в тому, що досить широко освоєний радіовуглецевий метод непридатний для визначення віку зразків в інтервалі 105...108 років (через велику різницю між періодами напіврозпаду 14С і довго-живучих ізотопів 40K, 82Rb, 232Th, 235U і 238U). Ізотоп 10Be якраз «заповнює» цей розрив.
- При горінні берилію виділяється багато тепла — 15тис. Ккал/кг, тому він може бути компонентом високоенергетичного ракетного пального. Варто відзначити високу токсичність і високу вартість металевого берилію, і в зв'язку з цим докладено значних зусиль для виявлення берилієвмісних палив, що мають значно меншу загальну токсичність і вартість. Однією з таких сполук берилію може бути гідрид берилію.
- Скловолокно, до складу якого входить окис берилію, може знайти застосування в конструкціях ракет і підводних човнів.
- Металевий берилій може слугувати надпровідником. Будучи сконденсований у вигляді тонкої плівки на холодну підкладку, він стає надпровідником при температурі близько 8 К.
- Теплоізоляційні властивості окису берилію можуть стати в пригоді і під час дослідження земних глибин. Так, існує проект взяття проб із мантії Землі з глибин до 32 км за допомогою так званої атомної голки. Це мініатюрний атомний реактор діаметром всього 60 см. Реактор повинен бути укладений у теплоізоляційний футляр з окису берилію з важким вольфрамовим наконечником. Принцип дії атомної голки такий: високі температури, створювані в реакторі (понад 1100 °C), викликають плавлення скельних порід і просування реактора до центру Землі. На глибині приблизно 32 км важке вольфрамове вістря повинне відокремитися, а реактор, ставши більш легким, ніж навколишні його породи, візьме проби з недосяжних поки глибин і «спливе» на поверхню.
Біологічна роль
Берилій виявлений у рослинах, які ростуть на берилієвмістих ґрунтах, а також в тканинах і кістках тварин. Вміст берилію в ґрунтах коливається від 2×10-4 до 1×10-3 %, в золі рослин близько 2×10-4 %. У тварин берилій розподіляється у всіх органах і тканинах, в золі кісток міститься від 5×10-4 до 7×10-3 % берилію. Його вміст в організмі середньої людини (маса тіла 70 кг) становить 0,036 мг, щоденне надходження з їжею — близько 0,01 мг. Близько 50 % засвоєного твариною берилію виділяється з сечею, близько 30 % поглинається кістками, 8 % виявлено в печінці та нирках.
Біологічне значення берилію мало з'ясовано. Воно визначається його участю в обміні Mg і Р в кістковій тканині. І якщо для рослини берилій відносно нешкідливий, то для тварин багато летючих та розчинних сполук берилію, а також пил, що містить берилій і його сполуки, дуже токсичні. Так при надлишку в раціоні солей берилію відбувається зв'язування в кишечнику іонів фосфорної кислоти в розчинний фосфат берилію. Активність деяких ферментів (лужної фосфатази, аденозинтрифосфатази) починає гальмуватись вже при малих концентраціях берилію. Таким чином постійно «викрадаючи» фосфати, берилій тим самим сприяє ослабленню кісткової тканини — що призводить до нестачі фосфору та може спровокувати не виліковну вітаміном D хворобу — «берилієвий рахіт». Зустрічається він в основному у тварин в біогеохімічних провінціях, багатих берилієм.
Берилій також заміщає у ферментах магній і володіє яскраво вираженою алергічною і канцерогенною дією. Вдихання його, та його багатьох сполук з атмосферного повітря може призвести до запальних процесів на шкірі та/або важкого захворювання органів дихання, як бериліоз. При короткочасному вдиханні великих концентрацій розчинних сполук берилію виникає гострий бериліоз, що представляє собою подразнення дихальних шляхів, іноді супроводжується набряком легенів і задухою. Є і хронічний різновид бериліозу, для якого характерні менш різкі симптоми, але більш великі порушення у функціях всього організму. Слід зазначити, що ці захворювання можуть виникнути через 10-15 років після припинення контакту з берилієм, і тому за таку підступну й згубну дію на живі організми берилій деколи називають «повзучою смертю». Для лікування бериліозу застосовують найчастіше хімічні сполуки, що зв'язують іони берилію і сприяють їх виведенню з організму.
Для повітря ГДК дуже мала, і в перерахунку на берилій становить всього 0,001 мг/м3. Це значно менше допустимих норм для більшості металів, навіть таких токсичних, як свинець.
Цікаві факти
- Під час Другої Світової війни німецька промисловість була відрізана від основних джерел берилієвої сировини. Виробництво берилієвої бронзи, яка була потрібна для виготовлення пружин швидкострільних авіаційних кулеметів, практично повністю перебувала під контролем США. Тоді німецькі промисловці вирішили використовувати нейтральну Швейцарію для контрабандного ввезення берилієвої бронзи — американські фірми отримали від нібито швейцарських годинникарів замовлення на таку її кількість, якої вистачило б на годинникові пружини всьому світу на кілька століть вперед. Німецький план був розгаданий, але протягом всієї війни до Німеччини іноді просочувалися поставки цієї стратегічної сировини.
- У 1964 році група радянських хіміків на чолі з віце-президентом Академії наук Таджицької РСР, доктором хімічних наук К. Т. Порошином, провела хімічний аналіз стародавнього цілющого засобу «мумійо». Виявилося, що ця речовина складного складу, а в числі багатьох елементів, що містяться в ній, є і берилій.
Примітки
- Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights(англ.)
- Beryllium: Beryllium(I) Hydride compound data. bernath.uwaterloo.ca. Архів оригіналу за 2 грудня 2007. Процитовано 10 грудня 2007.(англ.)
- Редкол.:Кнунянц И. Л. (гол. ред.). Химическая энциклопедия: в 5 т. — Москва : Советская энциклопедия, 1988. — Т. 1. — С. 280.(рос.)
- Haynes, William M., ред. (2011). CRC Handbook of Chemistry and Physics (вид. 92nd). Boca Raton, FL: CRC Press. с. 14.48. ISBN 1439855110.(англ.)
- Венецкий С.И. Металл космического века // Рассказы о металлах. — Москва : Металлургия, 1979. — 240 с. — 60000 прим.(рос.)
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- Состояние и перспективы мирового рынка бериллия(рос.)
Посилання
Література
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- U.S. Geological Survey, 2020, Mineral commodity summaries 2020: U.S. Geological Survey, 200 p., https://doi.org/10.3133/mcs2020.