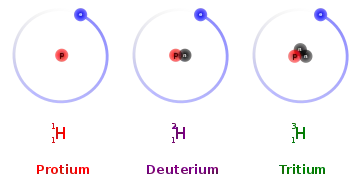
Ізотопи водню
Водень (Н) (Відносна атомна маса: 1.00794) має три ізотопи природного походження, які іноді позначають як 1H, 2H та 3H. Перші два з них є стабільними, а 3H має період напіврозпаду 12,32 року. Всі важчі ізотопи є синтетичними і мають період напіврозпаду менш як одну зептосекунду (10-21 секунди). З них 5H найбільш стабільний, а 7H найменш.[1][2]
Водень - єдиний елемент, чиї ізотопи мають різні імена, які перебувають у загальному вжитку сьогодні. Ізотоп 2H (або водень-2) зазвичай називають дейтерієм, тоді як ізотоп 3H (або водень-3) зазвичай називають тритієм. Символи D і Т (замість 2H і 3H) інколи використовують для дейтерію і тритію. IUPAC у Червоній книзі 2005 стверджує, що в той час як використання символів D і T є загальнопоширеним, воно не є найкращим, тому що може викликати проблеми з алфавітним сортуванням хімічних формул. Звичайний ізотоп водню, без нейтронів, іноді називають "протієм". (На початку дослідження радіоактивності, деяким іншим тяжчим радіоактивним ізотопам водню дали імена, але такі імена рідко використовують сьогодні.)
Водень-1 (протій)

1H (атомна маса 1.00782504(7) u)- найпоширеніший ізотоп водню, частка якого становить 99.98%. Оскільки ядро цього ізотопу складається лише з одного протона, то йому дали описову, але рідко формально вживану, назву протій.
Науковці ніколи не реєстрували розпаду протону, тому водень-1 вважають стабільним ізотопом. Деякі теорії великого об'єднання, запропоновані в 1970-х роках, прогнозують, що розпад протона може відбуватися з періодом напіврозпаду між 1031 і 1036 років. Якщо цей прогноз виявиться правильним, то водень-1 (і взагалі всі ядра, які нині вважають стабільними), виявляться лише експериментально стабільними. На сьогодні, втім, експерименти показали, що період напіврозпаду протона принаймні перевищує 1034 років.
Водень-2 (дейтерій)
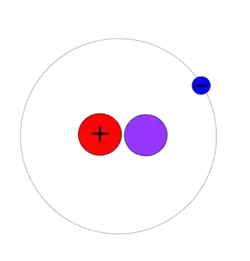
2H (атомна маса 2.013553212724(78) u), інший стабільний ізотоп водню, називається дейтерій і містить один протон і один нейтрон у ядрі атома. Ядро дейтерію називається дейтроном. Частка дейтерію становить 0.0026 – 0.0184% (за чисельною кількістю, а не за масою) від усієї кількості водню на Землі, причому нижню межу визначають у пробах газоподібного водню, а вище збагачення (0.015% або 150 частинок на мільйон) типове для океанської води. Водень на Землі багатший на дейтерій в порівнянні з його вихідною концентрацією в результаті Великого вибуху і в зовнішній Сонячній системі (близько 27 частинок на мільйон) і його концентрацією в старих частинах галактики Чумацький Шлях (близько 23 часток на мільйон). Імовірно, збільшену концентрацію дейтерію у внутрішній Сонячній системі можна пояснити нижчою волатильністю газоподібного дейтерію і з'єднань дейтерію відносно протію, що призвело до збагачення частки дейтерію на кометах і планетах, які отримували значну частину тепла від Сонця упродовж мільярдів років еволюції Сонячної системи.
Дейтерій не є радіоактивним і не становить значну небезпеку токсичності. Вода, молекули якої містять дейтерій замість протію, називається важкою водою. Дейтерій та його сполуки використовують як нерадіоактивні мітки в хімічних експериментах і в розчинниках для 1Н-ЯМР-спектроскопії. Важка вода використовується як сповільнювач нейтронів і теплоносій у ядерних реакторах. Дейтерій також є потенційним паливом для комерційного ядерного синтезу.
Водень-3 (тритій)
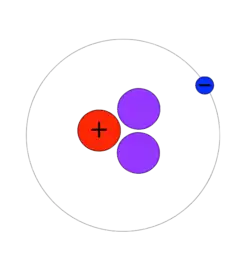
3H (атомна маса 3.0160492 u) відомий як тритій і містить один протон і два нейтрони в ядрі атома. Він радіоактивний і розпадається на гелії-3 в результаті β− розпаду. Період напіврозпаду становить 12.32 року.[3] Невелика кількість тритію утворюється природним шляхом внаслідок взаємодії космічних променів з атмосферними газами. Тритій також виникав під час випробувань ядерної зброї. Він використовується в термоядерній зброї, як індикатор в ізотопній геохімії, і є спеціалізованим елементом у приладах на тритієвій підсвітці.
Найпоширеніший спосіб видобутку тритію полягає в бомбардуванні природного ізотопу літію, літію-6, нейтронами в ядерному реакторі.
Раніше тритій постійно застосовували в хімічних і біологічних експериментах як ізотопну мітку, але цей метод останнім часом вийшов з широкого вжитку. Дейтерій-тритієва реакція ядерного синтезу використовує тритій як основний реагент, поряд з дейтерієм, вивільняючи енергію за рахунок втрати маси, коли їхні ядра зіштовхуються і зливаються за високих температур.
Водень-4
4H містить один протон і три нейтрони у своєму ядрі. Це дуже нестабільний ізотоп водню. Його синтезували в лабораторії, бомбардуючи тритій швидкими ядрами дейтерію.[4] У цьому експерименті, ядро тритію захоплювало нейтрон від швидкого ядра дейтерію. Присутність водню-4 визначили, виявивши випускання надлишкових протонів. Його атомна маса становить 4.02643 ± 0.00011.[5] Він руйнується випускаючи нейтрон на водень-3 (тритій) і має період напіврозпаду близько 139 йоктосекунд ((1.39 ± 0.10) × 10-22 секунд).[6]
У сатиричному романі Миша, яка загарчала, назву quadium дістав ізотоп водню-4, що дає енергію Q-бомбі, яку князівство Гранд Фенвік захопило у США.
Водень-5
5H - це вкрай нестабільний ізотоп водню. Ядро складається з протону і чотирьох нейтронів. Його синтезовано в лабораторії в результаті бомбардування тритію тритієвими ядрами.[4][7] В тому експерименті одне ядро тритію захоплювало два нейтрони з іншого, перетворюючись на ядро з одним протоном і чотирма нейтронами. Утворення водню-5 виводили з наявності залишкових протонів. Він руйнується внаслідок подвійного випускання нейтронів на водень-3 (тритій) і має період напіврозпаду не менш як 910 йоктосекунд (9.1 × 10-22 секунд).[6]
Водень-6
6H розпадається або через потрійне випускання нейтронів на водень-3 (тритій) або після випускання чотирьох нейтронів на водень-2 (дейтерій) і має період напіврозпаду 290 йоктосекунд (2.9×10-22 секунд).[6]
Водень-7
7H складається з протону і шести нейтронів. Його вперше синтезувала 2003 року група російських, японських і французьких вчених у RI Beam Science Laboratory центру RIKEN, бомбардуючи водень атомами гелію-8. В результаті реакції, всі шість нейтронів гелію-8 перейшли в ядро водню. Два залишкових протони були виявлені "телескопом РІКЕН", приладом, що складається з декількох шарів датчиків, розташованих позаду мішені RI Beam циклотрону.[2] Водень-7 має період напіврозпаду 23 йоктосекунди (2.3×10-23 с.).
Таблиця
| Символ ізотопу |
Z(p) | N(n) | маса ізотопу (u) | період напіврозпаду | типи розпаду[8] |
Дочірні ізотопи[n 1] | Спін і парність ядра |
Поширеність ізотопу в природі (мольна частка)[n 2] |
діапазон розподілу в природі (мольна частка) |
|---|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1.00782503207(10) | Стабільний[n 3][n 4] | 1⁄2+ | 0.999885(70) | 0.999816–0.999974 | ||
| 2H[n 5] | 1 | 1 | 2.0141017778(4) | Стабільний | 1+ | 0.000115(70)[n 6] | 0.000026–0.000184 | ||
| 3H[n 7] | 1 | 2 | 3.0160492777(25) | 12.32(2) років | β− | 3He | 1⁄2+ | Сліди[n 8] | |
| 4H | 1 | 3 | 4.02781(11) | 1.39(10)×10−22 с [4.6(9) MeV] |
n | 3H | 2− | ||
| 5H | 1 | 4 | 5.03531(11) | >9.1×10−22 с ? | 2n | 3H | (1⁄2+) | ||
| 6H | 1 | 5 | 6.04494(28) | 2.90(70)×10−22 с [1.6(4) MeV] |
3n | 3H | 2−# | ||
| 4n | 2H | ||||||||
| 7H | 1 | 6 | 7.05275(108)# | 2.3(6)×10−23 с# | 4n | 3H | 1⁄2+# | ||
- Жирним для стабільних ізотопів
- Йдеться про воду.
- Більший, ніж 6.6×1033 років. Див. розпад протона.
- Він і 3He є єдиними стабільними нуклідами, у яких протонів більше, ніж нейтронів
- Утворився під час нуклеосинтезу Великого вибуху
- Tank hydrogen має частку 2H 3.2×10−5 (мольної частки).
- утворився під час нуклеосинтезу Великого вибуху, але не є первинним, оскільки всі ті атоми відтоді розпались до 3He
- Космогенний
Нотатки
- Комерційно доступні матеріали можуть підлягати прихованому або випадковому розділенню на ізотопи. Можуть траплятись суттєві відхилення від поданої маси і складу.
- Оцінки позначені # отримані не з чисто експериментальних даних, але частково із систематичних трендів у сусідніх нкулідів (з такими самими відношеннями Z і N). Спіни зі слабким оцінковим обґрунтуванням взяті в дужки.
- похибку вимірювання подано в скороченій формі в дужках після відповідних останніх цифр. Похибка позначає одне стандартне відхилення, за винятком ізотопної поширеності та атомної маси від IUPAC, яка використовує складніші визначення похибок. Приклади: 29770,6(5) означає 29770,6 ± 0,5; 21,48(15) означає 21,48 ± 0,15; −2200,2(18) означає −2200,2 ± 1,8.
- Маси радіонуклідів подані за даними Комісії з символів, одиниць, номенклатури, атомних мас і фундаментальних констант (SUNAMCO) IUPAP
- Поширеності ізотопів подані за даними Комісії з ізотопних поширеностей і атомних мас IUPAC
Ланцюги розпаду
Більшість важких ізотопів водню розпадаються прямо на 3H, який потім розпадається до стабільного ізотопу 3Не. Проте, іноді спостерігали і безпосередній розпад 6H на стабільний 2H.
зверніть увагу, що часи розпадів вказані в йоктосекундах для всіх ізотопів, крім 3H, для якого цей показник виражений у роках.
Див. також
- Ізотопи гелію
- Біогеохімія ізотопів водню
Примітки
- Y. B. Gurov (2004). Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei 68 (3): 491–497. Bibcode:2005PAN....68..491G. doi:10.1134/1.1891200.
- A. A. Korsheninnikov (2003). Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Physical Review Letters 90 (8): 082501. Bibcode:2003PhRvL..90h2501K. doi:10.1103/PhysRevLett.90.082501.
- G. L. Miessler; D. A. Tarr (2004). Inorganic Chemistry (вид. 3rd). Pearson Prentice Hall. ISBN 978-0-13-035471-6.
- G. M. Ter-Akopian (2002). Hydrogen-4 and Hydrogen-5 from t+t and t+d transfer reactions studied with a 57.5-MeV triton beam. AIP Conference Proceedings 610: 920. doi:10.1063/1.1470062.
- M. Wang; G. Audi; A. H. Wapstra; F. G. Kondev; M. MacCormick; X. Xu; B. Pfeiffer (2012). The Ame2012 atomic mass evaluation (II). Tables, graphs, and references. Chinese Physics C 36 (12): 7. doi:10.1088/1674-1137/36/12/003. Архів оригіналу за 14 лютого 2017. Процитовано 25 грудня 2016.
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. Архів оригіналу за 20 липня 2011. Процитовано 25 грудня 2016.
- A. A. Korsheninnikov (2001). Superheavy Hydrogen 5H. Physical Review Letters 87 (9): 92501. Bibcode:2001PhRvL..87i2501K. doi:10.1103/PhysRevLett.87.092501.
- http://www.nucleonica.net/unc.aspx
Посилання
- General references
- Маси ізотопів взяті з:
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- Кількісні співвідношення ізотопів і стандартні атомні маси взяті з:
- J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor (2003). Atomic weights of the елементs. Review 2000 (IUPAC Technical Report). Pure and Applied Chemistry 75 (6): 683–800. doi:10.1351/pac200375060683.
- M. E. Wieser (2006). Atomic weights of the елементs 2005 (IUPAC Technical Report). Pure and Applied Chemistry 78 (11): 2051–2066. doi:10.1351/pac200678112051. Загальний огляд.
- Період напіврозпаду, спін, і дані ізомерів взяті з: See editing notes on this article's talk page.
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003). The NUBASE evaluation of nuclear and decay properties. Nuclear Physics A 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- National Nuclear Data Center. NuDat 2.1 database. Brookhaven National Laboratory. Процитовано September 2005.
- N. E. Holden (2004). Table of the Ізотопи. У D. R. Lide. CRC Handbook of Chemistry and Physics (вид. 85th). CRC Press. Section 11. ISBN 978-0-8493-0485-9.
Література
- B. Dumé (7 березня 2003). Hydrogen-7 makes its debut. Physics World.
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||