Бензоїнова конденсація
Бензої́нова конденса́ція (англ. benzoin addition) — реакція приєднання двох молекул альдегідів з утворенням α-оксикетону (ацилоїну). Є одним з основних методів одержання ацилоїнів. Реагентами в бензоїновій конденсації виступають бензальдегіди (з утворенням бензоїнів), а також гліоксалі .[2][3]

Бензоїнову конденсацію було відкрито в 1832 році Юстусом фон Лібіхом і Фрідріхом Велером під час досліджень олії гіркого мигдалю.[4] Каталітичний варіант реакції з використанням ціанідів був розроблений через декілька років Ніколаєм Зініним.[5][6]
Механізм реакції
Загальноприйнятий механізм бензоїнової конденсації був уперше запропонований Артуром Лапвортом у 1903 році:[7]

Механізм у анімованому вигляді:
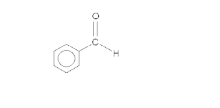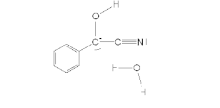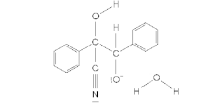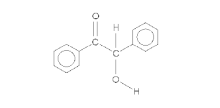
Згідно наведеного вище механізму, один із реагуючих альлдегідів зберігає карбонільну функціональність, у той час як інший відновлюється до алкоголю. Термінологічно перший альдегід (на схемі це чорна молекула) називають донором, бо він «донорує» атом водню другому альдегіду; відповідно, другий альдегід (червона молекула) називають акцептором. Деякі бензальдегіди можуть виконувати тільки одну з цих функцій, тому можуть бути застосовані тільки в перехресних конденсаціях; наприклад, пара-диметиламінобензальдегід може слугувати лише донором.
Кожен механістичний крок є рівноважним, тому підвищені температури сприяють швидшому перебігу реакції.
Ключовим кроком в бензоїновій конденсації є умполюнґ карбонільної групи альдегіду-донора в результаті утворення нітрилоеноляту. Через це ціанід-іон є унікальним каталізатором в цій реакції, бо він одночасно виконує всі три важливі функції в її механізмі: 1) нуклеофільне приєднання до карбонільної групи; 2) підвищення кислотності альдегідного атома водню за рахунок її електроноакцепторних властивостей; 3) відщеплення після конденсації з альдегідом-акцептором.
Модифікації
Класична процедура бензоїнової конденсації має певні недоліки: 1) використання токсичних ціанідів; 2) низька енантіоселективність і 3) неможливість гомо-конденсації деяких бензальдегідів. Останню проблему можна вирішити, якщо альдегід, який може виступати тільки в якості акцептору, додавати до реакції у формі його ціангідрину;[8] в такому випадку, додавання ціаніду не є необхідним.
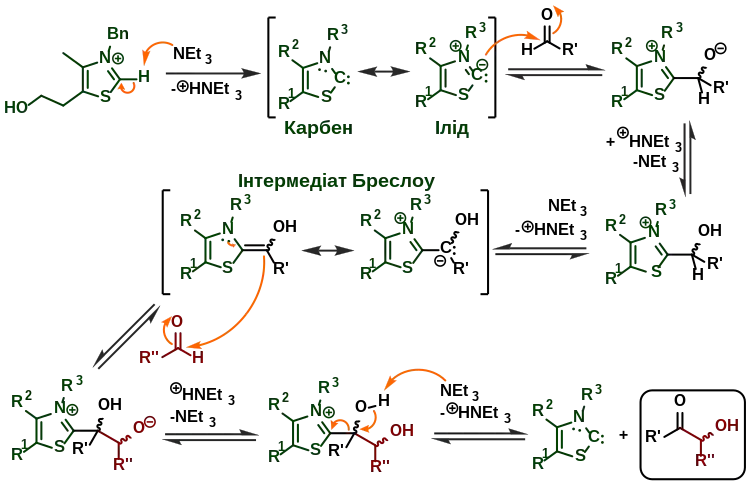
Високу енантіоселективність бензоїнової конденсації вдалося досягти шляхом каталізу бензоїлформат-декарбоксилазою.[9] Ця реакція також не потребує ціанід-іонів. Однак найвідоміша «безціанідна» бензоїнова конденсація вживає похідні тіаміну — т. зв. «каталізатори Штеттера»[10]. За допомогою цього метода можна одержувати ацилоїни загалом. Механізм реакції наведено нижче; його особливістю є властивість похідних тіаміну утворювати N-гетероциклічні карбени, які реагують з альдегідом-донором на кшталт ціанідів. Подальше депротонування призводить до т. зв. інтермедіатів Бреслоу, структура яких була запропонована Рональдом Бреслоу в 1958.[11]
Примітки
- Roger Adams, C. S. Marvel (1921). Benzoin. Organic Syntheses 1: 33. doi:10.15227/orgsyn.001.0033.
- Ide, Walter S.; Buck, Johannes S. (15 березня 2011). У John Wiley & Sons, Inc. The Synthesis of Benzoins. Organic Reactions (англ.). Hoboken, NJ, USA: John Wiley & Sons, Inc. с. 269–304. ISBN 978-0-471-26418-7. doi:10.1002/0471264180.or004.05.
- Smith, Michael B.; March, Jerry (27 грудня 2006). March's Advanced Organic Chemistry (англ.). Hoboken, NJ, USA: John Wiley & Sons, Inc. ISBN 978-0-470-08496-0. doi:10.1002/0470084960.
- Wöhler; Liebig (1832). Untersuchungen über das Radikal der Benzoesäure. Annalen der Pharmacie (нім.) 3 (3). с. 249–282. doi:10.1002/jlac.18320030302.
- N. Zinin (1839). Beiträge zur Kenntniss einiger Verbindungen aus der Benzoylreihe. Annalen der Pharmacie 31 (3): 329–332. doi:10.1002/jlac.18390310312.
- N. Zinin (1840). Ueber einige Zersetzungsprodukte des Bittermandelöls. Annalen der Pharmacie 34 (2): 186–192. doi:10.1002/jlac.18400340205.
- Lapworth, A. (1904). CXXII.—Reactions involving the addition of hydrogen cyanide to carbon compounds. Part II. Cyanohydrins regarded as complex acids. Journal of the Chemical Society, Transactions 85: 1206–1214. doi:10.1039/CT9048501206.
- Rozwadowska, Maria D. (1 січня 1985). Cyanohydrins as substrates in benzoin condensation.: Regiocontrolled mixed benzoin condensation. Tetrahedron (англ.) 41 (15). с. 3135–3140. ISSN 0040-4020. doi:10.1016/S0040-4020(01)96667-0.
- Demir, Ayhan S; Dünnwald, Thomas; Iding, Hans; Pohl, Martina; Müller, Michael (17 грудня 1999). Asymmetric benzoin reaction catalyzed by benzoylformate decarboxylase. Tetrahedron: Asymmetry (англ.) 10 (24). с. 4769–4774. ISSN 0957-4166. doi:10.1016/S0957-4166(99)00516-9.
- Stetter, Hermann (1976). Catalyzed Addition of Aldehydes to Activated Double Bonds—A New Synthetic Approach. Angewandte Chemie International Edition in English (англ.) 15 (11). с. 639–647. ISSN 1521-3773. doi:10.1002/anie.197606391.
- Breslow, Ronald (1 липня 1958). On the Mechanism of Thiamine Action. IV.1 Evidence from Studies on Model Systems. Journal of the American Chemical Society 80 (14). с. 3719–3726. ISSN 0002-7863. doi:10.1021/ja01547a064.