Благородні гази
Бла́горо́дні га́зи (також іне́ртні або рі́дкісні гази) (англ. noble gases; нім. іnertgase) — хімічні елементи VIII групи головної підгрупи періодичної системи елементів, або за новою номенклатурою IUPAC групи 18 періодичної таблиці, які мають схожі властивості та за нормальних умов є одноатомними газами без кольору, запаху та смаку з дуже низькою хімічною реактивністю, котра зумовлена наявністю у атомів стійкої зовнішньої електронної оболонки, де у неї знаходиться 2 електрони та у решти інертних газів по 8. До благородних газів відносяться гелій (Не), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Хе) та радіоактивний радон (Rn). Останнім часом до цієї групи також зараховують оганесон.
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| Група 18 періодичної таблиці (Інертні гази) |
У невеликих кількостях присутні в природних горючих газах.
Частина інертних газів має космогенне походження. У земних умовах інертні гази також продовжують утворюватися під час ядерних процесів.
Фізичні властивості
| Елемент | Гелій (3He та 4He) | Неон | Аргон | Криптон | Ксенон | Радон | |
|---|---|---|---|---|---|---|---|
| Забарвлення газового розряду |  |  |  |  |  | Червоне[1] | |
| Т° плавлення | 0,319 K (29,315 бар) | 0,775 K (25,316 бар) | 24,57 K | 84,0 K | 116,2 K | 161,4 K | бл. 202 K |
| Т° кипіння (1013 гПа) | 3,1905 K | 4,224 K | 27,09 K | 87,295 K | 119,79 K | 165,03 K | 211 K |
| Критична точка |
|
|
|
|
|
|
|
| Потрійна точка | немає даних |
|
|
|
|
| |
| Густина (0 °C, 1013 гПа) | 0,13448 кг/м3 | 0,17847 кг/м3 | 0,9000 кг/м3 | 1,7839 кг/м3 | 3,7493 кг/м3 | 5,8971 кг/м3 | 9,73 кг/м3 |
| Структура | 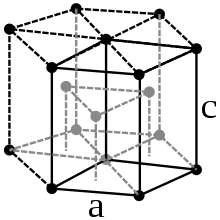 |  |  |  |  |  | |
| Сингонія | гексагональна | кубічна | кубічна | кубічна | кубічна | кубічна | |
| Параметри ґратки[2] |
|
a = 4,43 Å | a = 5,26 Å | a = 5,72 Å | a = 6,20 Å | a = 6,55 Å (розраховано)[3] | |
Хімічні властивості
Інертні гази відрізняються хімічною неактивністю (звідси і назва). Проте, в 1962 році Ніл Барлетт показав, що усі вони за певних умов можуть утворювати сполуки (особливо охоче з флуором). Найбільш «інертні» неон і гелій : щоб змусити їх вступити в реакцію, треба застосувати багато зусиль, штучно іонізуючи кожен атом. Аргон можна профторувати за жорстких умов у дифторид.[4] Ксенон же, навпаки, занадто активний (для інертних газів) і реагує навіть за нормальних умов, демонструючи мало не усі можливі міри окислення (+1, +2, +4, +6, +8).[5] Радон теж має високу хімічну активність, але він сильно радіоактивний і швидко розпадається, тому детальне вивчення його хімічних властивостей ускладнене, на відміну від ксенону. Оганесон, незважаючи на його приналежність до 8 групи періодичної таблиці, може не бути інертним газом, оскільки передбачається, що за нормальних умов у силу релятивістських ефектів він знаходитиметься у твердому стані.
Біологічна дія
Інертні гази не отруйні. Проте атмосфера зі збільшеною концентрацією інертних газів і відповідним зниженням концентрації кисню може чинити задушливу дію на людину, аж до втрати свідомості і смерті. Відомі випадки загибелі людей при витоках аргону. Вдихання радіоактивного радону може викликати рак.
Інертні гази мають біологічну дію, яка проявляється в їх наркотичній дії на організм і по силі цієї дії розташовуються в такому порядку (в порівнянні приведені також азот і водень) : Xe — Kr — Ar — N2 — H2 — Ne — He. При цьому ксенон і криптон проявляють наркотичний ефект при нормальному барометричному тиску, аргон — при тиску понад 0,2 МПа, азот — понад 0,6 МПа, водень — понад 2,0 МПа. Наркотична дія неону і гелію в дослідах не реєструються, оскільки під тиском раніше виникають симптоми «нервового синдрому високого тиску».
Примітки
- Klaus Hoffmann: Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente. Urania-Verlag, Leipzig • Jena • Berlin 1979, S. 67. (нім.)
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, 30, S. 193-204.
- A. V. Grosse: Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em). In: Journal of Inorganic and Nuclear Chemistry. 1965, 27, 3, S. 509-519, DOI:10.1016/0022-1902(65)80255-X.
- Lehmann, J (2002). The chemistry of krypton. Coordination Chemistry Reviews. 233–234: 1–39. doi:10.1016/S0010-8545(02)00202-3.
- Moody, G. J. (1974). A Decade of Xenon Chemistry. Journal of Chemical Education 51 (10): 628–630. Bibcode:1974JChEd..51..628M. doi:10.1021/ed051p628. Процитовано 16 жовтня 2007.
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Ахметов Н. С. Загальна та неорганічна хімія. — М. : Вища школа, 2001. — ISBN 5-06-003363-5.
- Лідин Р. А.. Довідник із загальної та неорганічної хімії. — М. : колоси, 2008. — ISBN 978-5-9532-0465-1.
- Некрасов Б. В. Основи загальної хімії. — М. : Лань, 2004. — ISBN 5-8114-0501-4.
- Спіцин В. І., Мартиненко Л. І. Неорганічна хімія. — М. : МДУ, 1991, 1994.
- Турова Н. Я. Неорганічна хімія в таблицях. Навчальний посібник. — М. : ЧеРо, 2002. — ISBN 5-88711-168-2.
- Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford:Butterworth-Heinemann, ISBN 0-08-037941-9
- F. Albert Cotton, Carlos A. Murillo, and Manfred Bochmann, (1999), Advanced inorganic chemistry. (6th ed.), New York:Wiley-Interscience, ISBN 0-471-19957-5
- Housecroft, C. E. Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall, ISBN 978-0-13-175553-6