Електронна оболонка
Електро́нна оболо́нка — група вироджених або близьких за енергією електронних орбіталей атома.
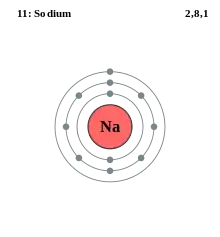
На кожній з оболонок може розташовуватися лише певне число електронів (див. принцип виключення Паулі).
Розрізняють внутрішні й зовнішні (валентні) електронні оболонки.
Внутрішні оболонки відповідають за спектри рентгенівського випромінювання та спектри рентгенівського поглинання атомів. Зовнішні — за хімічні властивості атома.
Оболонки бувають заповненими, незаповненими та частково заповненими.
Основою класифікації електронних оболонок є енергетичний спектр атома водню. В атомі водню, якщо його розглядати, використовуючи нерелятивістську квантову механіку, енергія електронної орбіталі залежить тільки від головного квантового числа. s-, p-, d-орбіталі, що відповідають одному головному квантовому числу мають однакову енергію. При врахуванні релятивістських ефектів, однак, виродження частково знімається, тобто в спектрі з'являється тонка структура.
Електронні оболонки складніших атомів із більшим числом електронів будуються на основі класифікації атомних орбіталей. Проте, на відміну від атома водню, енергії s-, p-, d- та f-орбіталей мають різне значення. Це розщеплення зумовлене різними причинами: врахуванням релятивістських ефектів, зокрема, спін-орбітальною взаємодією, екрануванням ядра внутрішніми оболонками, надтонкою структурою. Тому кожна з електронних оболонок розпадається на підоболонки.
Традиційно для важких елементів оболонку з найменшою енергією називають К-оболонкою, наступну за енергією оболонку — L-оболонкою, і так далі.
Оболонки
Електронні оболонки позначаються літерами K, L, M, N, O, P, Q або цифрами від 1 до 7. Підрівні оболонок позначаються літерами s, p, d, f, g, h, i або цифрами від 0 до 6. Електрони зовнішніх оболонок володіють більшою енергією і, порівняно з електронами внутрішніх оболонок, знаходяться далі від ядра, що робить їх важливішими в аналізі поведінки атома в хімічних реакціях і в ролі провідника, оскільки їх зв'язок з ядром слабше і легше розривається.
Кількість електронів в кожній оболонці
Дана кількість обчислюється за формулою:
- , де N — номер оболонки.
| рівень/підрівень | 0 (s) | 1 (p) | 2 (d) | 3 (f) | 4 (g) | 5 (h) | 6 (i) | Всього в оболонці |
|---|---|---|---|---|---|---|---|---|
| 1 (K) | 2 | 2 | ||||||
| 2 (L) | 2 | 6 | 8 | |||||
| 3 (M) | 2 | 6 | 10 | 18 | ||||
| 4 (N) | 2 | 6 | 10 | 14 | 32 | |||
| 5 (O) | 2 | 6 | 10 | 14 | 18 | 50 | ||
| 6 (P) | 2 | 6 | 10 | 14 | 18 | 22 | 72 | |
| 7 (Q) | 2 | 6 | 10 | 14 | 18 | 22 | 26 | 98 |
Підрівні оболонок
Кожна оболонка складається з одного або декількох підрівнів, кожен з яких складається з атомних орбіталей.
Наприклад, перша оболонка (K) складається з одного підрівня 1s. Друга оболонка (L) складається з двох підрівнів, 2s і 2p. Третя оболонка (M) — з 3s, 3p і 3d. Четверта (N) — з 4s, 4p, 4d, 4f.
Можливі варіанти підрівнів оболонок наведені в наступній таблиці:
| Позначення підрівня | l | Макс. кіл-сть електронів | Вміст в оболонках | Історична назва |
|---|---|---|---|---|
| s | 0 | 2 | У кожній | sharp |
| p | 1 | 6 | У всіх з 2 | principal |
| d | 2 | 10 | У всіх з 3 | diffuse |
| f | 3 | 14 | У всіх з 4 | fundamental |
| g | 4 | 18 | У всіх з 5 | (Тут і далі алфавітний порядок) |
| h | 5 | 22 | У всіх з 6 | |
| i | 6 | 26 | У всіх з 7 |
Валентні оболонки
Валентна оболонка — зовнішня оболонка атома. Електрони цієї оболонки часто невірно називають валентними електронами, тобто електронами, що визначають поведінку атома в хімічних реакціях. З точки зору хімічної активності, найменш активними вважаються атоми, в яких валентна оболонка остаточно заповнена (інертні гази). Найбільшою хімічною активністю володіють атоми, в яких валентна оболонка складається всього з одного електрона (лужні метали), і атоми, в яких одного електрона не вистачає для остаточного заповнення оболонки (галогени).
Є й інше пояснення. Поведінка атома в хімічних реакціях визначають електрони, що володіють більшою енергією, тобто ті електрони, які розташовані далі від ядра. Електрони внутрішніх підрівнів оболонок мають меншу енергію, ніж електрони зовнішніх підрівнів. Незважаючи на те, що електрони підрівня оболонки 3d можуть не належати до т. зв. валентної оболонки, вони можуть мати енергію більшу, ніж електрони підрівні оболонки 4s, що робить їх валентними електронами.
Див. також
- Атомна орбіталь
- Квантові числа
- Будова атома
- Електронна конфігурація атома
- Енергетичні рівні електронів
