Десмосома
Десомосома — тип міжклітинних контактів, що характеризується наявністю біля плазматичної мембрани білкової пластинки прикріплення, до якої із цитоплазматичного боку приєднуються проміжні філаменти[1]. Десмосоми сполучають клітини між собою, як заклепки, забезпечуючи механічну міцність тканин.
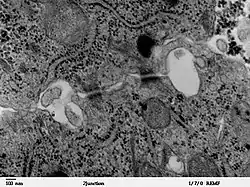
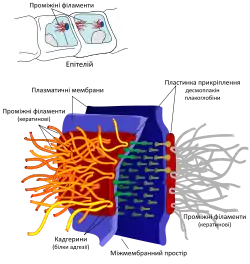
Схожі за будовою структури, що кріплять клітину до позаклітинного матриксу називаються гемідесмосомами[2].
Поширення
Десомосоми зустрічаються у більшості тканин хребетних тварин, проте, не знайдені у плодової мушки[3]. Найпоширеніші вони у тих частинах тіла, які зазнають постійного механічного стресу, зокрема у скелетних м'язах, міокарді[4], де разом із адгезивними контактами формують вставні диски, та більшості епітеліїв, особливо в епідермі. Для біохімічних досліджень десмосоми виділяють з епідерми носа корови[3][5].
Будова

Десомосоми — це переважно круглі ділянки з'єднання клітин, що нагадують заклепки, із діаметром близько 0,5 мкм. Відстань між мембранами у десомосомі становить 25—30 нм, щілина між ними заповнена електронно-щільною речовиною[2], а саме білками десмоглеїном та десмоколіном. Обидва належать до родини молекул клітинної адгезії кадгеринів[6], для них характерна наявність п'яти тандемних позаклітинних доменів. Молекули десмоглеїну та десмоколіну комплементарні між собою, у присутності іонів кальцію десмоглеїн на поверхні однієї клітини зв'язується із десмоколіном на сусідній і навпаки, таким чином вони зчеплюють клітини за принципом липучки[7].
У ділянці десмосоми до плазматичної мембрани з внутрішньої сторони прилягає пластинка прикріплення, що має товщину близько 40 нм і складається з якірних білків. Пластинка прикріплення поділяється на дві частини: зовнішню, розташовану ближче до мембрани, та внутрішню, повернуту до цитоплазми. До складу зовнішньої пластинки прикріплення входять внутрішньоклітинні домени кадгеринів, а також білки, що містять домени armadillo, плакоглобін (родина β-катенінів) та плакофілін (родина p120-катеніну). Внутрішня частина пластинки прикріплення складається із десмоплакіну — великого білка із глобулярними N- та C-кінцевими доменами, розміром у 1000 амінокислот, розділеними центральною α-спіраллю, приблизно такої ж довжини. Десмоплакін формує димери на основі утворення подвійної спіралі (англ. coiled coil) внаслідок взаємодії центральних доменів. N-кінцеві ділянки цих димерів контактують із плакофіліном, а N-кінцеві — із мотузкоподібними проміжними філаментами[7]. Частина проміжних філаментів розташовується паралельно до мембрани, інші наскрізь перетинають клітину[6]. Їх конкретний тип різниться в залежності від тканини: в епітелії це кератинові філаменти, у серцевому м'язі — десмінові[3].
Функції
Будова десмосом та їхнє сполучення із проміжними філаментами дозволяє рівномірно розподілити тиск між клітинами в тканині, що важливо для запобігання розривів[4]. При дуже сильних фізичних навантаженнях десмосоми можуть руйнуватись, зокрема це інколи спостерігається при розтягненні м'язів[8].
Порушення
Дисфункція десмосом в першу чергу проявляється у порушенні функціонування тих органів, де вони найбільше поширені, зокрема шкіри та серця. Наприклад рідкісне та потенційно летальне[3] аутоімунне захворювання — пухирниця звичайна (лат. Pemphigus vulgaris), що супроводжується виникненням пухирів на шкірі та слизових оболонках, виникає внаслідок вироблення антитіл до десмоглеїну, які перешкоджають утворенню міжклітинних контактів. Додавання таких антитіл у нормальну шкіру також спричинює виникнення пухирів. Саме при дослідженні цієї хвороби були вперше відкриті десмоглеїни[6].
Інший розлад пов'язаний із десмосомами — аритмогенна кардіоміопатія правого шлуночка[7].
Джерела
- Harvey Lodish et al. (2000). [http://www.ncbi.nlm.nih.gov/books/NBK21607/def-item/A7446/ Glossary]. Molecular Cell Biology (вид. 4th). W H Freeman. ISBN 0-7167-3136-3. — Переглянуто 13 березня 2012
- Луцик О. Д., Іванова А. Й., Кабак К. С., Чайковський Ю. Б. (2003). Гістологія людини. Київ: Книга плюс. ISBN 966-7619-39-7.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- Marieb EN, Hoehn K (2006). Human Anatomy & Physiology (вид. 7th). Benjamin Cummings. ISBN 978-0805359091.
- Skerrow CJ, Matoltsy AG. (1974). Isolation of epidermal desmosomes. J Cell Biol. 63: 515–23. PMID 4138144. doi:10.1083/jcb.63.2.515.
- Harvey Lodish et al. (2000). [http://www.ncbi.nlm.nih.gov/books/NBK21599/ 22.1 Cell-Cell Adhesion and Communication]. Molecular Cell Biology (вид. 4th). W H Freeman. ISBN 0-7167-3136-3. — Переглянуто 5 березня 2012
- Stokes DL (2007). Desmosomes from a structural perspective. Curr Opin Cell Biol. 19: 565–71. PMID 17945476. doi:10.1016/j.ceb.2007.09.003.
- Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. ISBN 978-0321543257.
Література
- Waschke J (2008). The desmosome and pemphigus. Histochem Cell Biol. 130: 21–54. PMID 18386043. doi:10.1007/s00418-008-0420-0.
- Garrod D, Chidgey M (2007). Desmosome structure, composition and function. Biochim Biophys Acta. 1778: 572–87. PMID 17854763. doi:10.1016/j.bbamem.2007.07.014.
- Delva E, Tucker DK, Kowalczyk AP (2009). The desmosome. Cold Spring Harb Perspect Biol. PMID 20066089. doi:10.1101/cshperspect.a002543.
- Kottke MD, Delva E, Kowalczyk AP (2006). The desmosome: cell science lessons from human diseases. J Cell Sci. 119: 797–806. PMID 16495480. doi:10.1242/jcs.02888.