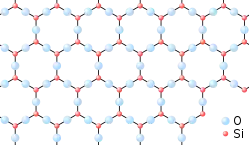
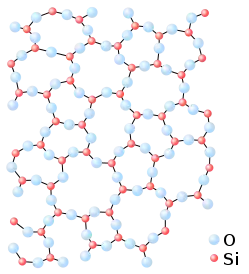
Діоксид кремнію
Діокси́д кре́мнію, силі́цій(IV) окси́д (кремнезем, SiO2) (рос. диоксид кремния, кремнезем, англ. silica, нім. Siliziumdioxid n) — сполука ковалентної природи.

Загальний опис
Найвідоміший мінерал — кварц, що має вигляд безбарвних кристалів із tпл 1713–1728 °C та високою твердістю і міцністю. При високих температурах діокси́д кре́мнію існує в молекулярному вигляді. Молекула SiO2 має лінійну форму, довжини зв'язків Si-O 1.495 Å. Є надзичайно реакційноздатною, тому зафіксована лише спектроскопічно. Втім, методами матричної ізоляції зафіксовано димер (SiO2)2 та тример (SiO2)3, що мають, відповідно, симетрії D2h та D3h.
Кремнезем — один з найважливіших і найпоширеніших мінералів кремнію. Формула: SiO2. У природі буває у вигляді кварцу, гірського кришталю тощо. Крім того під терміном кремнезем часто розуміють будь-яку поліморфну модифікацію діоксиду кремнію.
Діоксид силіцію зустрічається в природі головним чином у вигляді мінералу кварцу. Це дуже тверда речовина з температурою плавлення 1728°С. Великі прозорі і безбарвні кристали природного кварцу називають гірським кришталем. Кварц входить до складу багатьох гірських порід, наприклад граніту, гнейсу тощо. Звичайний пісок складається з дрібненьких кристалітів кремнезему. Пісок, що складається з чистого кварцового скла, зветься кварцовим і використовується в промисловості, зокрема, для добування металічного кремнію. У чистому вигляді пісок має білий колір, але здебільшого він буває забарвлений домішками сполук заліза в жовтуватий колір.
Інколи діоксид силіцію зустрічається в природі в аморфному стані. Таку речовину називають трепелом, або інфузорною землею. Місцями трепел утворює значні поклади, які виникли з залишків деяких водоростей, до складу яких входить діоксид силіцію.
У хімічному відношенні діоксид силіцію є кислотним оксидом — ангідридом силікатної кислоти H2SiO3. Однак з водою SiO2 безпосередньо не взаємодіє, тому силікатну кислоту можна одержати лише посереднім шляхом. Кислоти на SiO2 теж не діють, за винятком фторидної кислоти, яка дуже енергійно реагує з ним :
- SiO2 + 4HF = SiF4↑ + 2H2O
З основними оксидами і твердими лугами при високій температурі SiO2 утворює солі, які називають силікатами, наприклад:
- SiO2 + CaO = CaSiO3
Здатен відновлюватись до моноксиду кремнію при взаємодії з вугіллям чи чистим кремнієм:
- SiO2 + C = SiO + CO
Використання
Діоксид кремнію є природним ізолятором у кремнієвій мікроелектроніці. Тонка плівка діоксиду кремнію утворюється на поверхні напівпровідника при контакті з повітрям і створює необхідні для транзисторів діелектричні шари. Аморфний непористий діоксид кремнію застосовується в харчовій промисловості як допоміжна речовина E551, що перешкоджає злежуванню та грудкуванню, парафармацевтиці (зубні пасти), у фармацевтичній промисловості як допоміжна речовина (внесений до більшості Фармакопей), а також дієтична добавка або лікарський препарат як ентеросорбент[1].
Див. також
Примітки
- Энтеросорбенты: против отравлений. «Фармацевтический вестник» № 8 (668) Март 06, 2012 г.
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
Інтернет-ресурси
- Formation of silicon oxide layers in the semiconductor industry. LPCVD and PECVD method in comparison. Stress prevention.
- Quartz SiO2 piezoelectric properties
- Silica (SiO2) and Water
- Epidemiological evidence on the carcinogenicity of silica: factors in scientific judgement by C. Soutar and others. Institute of Occupational Medicine Research Report TM/97/09
- Scientific opinion on the health effects of airborne silica by A Pilkington and others. Institute of Occupational Medicine Research Report TM/95/08