Кристал
Криста́л (англ. crystal, нім. Kristall m) — тверде тіло з упорядкованою внутрішньою будовою, що має вигляд багатогранника з природними плоскими гранями: впорядкованість будови полягає у певній повторюваності у просторі елементів кристала (атомів, молекул, йонів), що зумовлює виникнення т. зв. кристалічної ґратки.





Завдяки подібній будові кристалічні речовини мають характерні властивості, як:
З кристалів складаються сніг і лід, гірські породи, цукор тощо.
Форми кристалів поділяють на сингонії.
Речовини, що не мають кристалічної ґратки, називають аморфними речовинами.
Загальна характеристика
Поверхня кристала обмежена площинами — гранями, лінії перетину яких є ребрами, а точки перетину ребер — вершинами. Кристал є обмежений гранями однієї або декількох простих форм (всього 47 простих форм). Проста форма — сукупність кристалографічно однакових граней. Форма реальних кристалів звичайно відрізняється від ідеальної форми (габітусу). Серед 31 точкових груп виділяють 7 сингоній кристалів: триклінну, моноклінну, ромбічну, тетрагональну, гексагональну, тригональну, кубічну.
Фізичні властивості кристалів визначаються їх складом, геометрією кристалічної структури і типом хімічного зв'язку в них. Основні властивості кристалів — однорідність, анізотропія і здатність до самоограновування. Зв'язок симетрії кристалів, симетрії їх фізичних властивостей і залежність останніх від симетрії зовнішніх впливів визначається принципами Кюрі і Неймана. Властивості кристалів описуються відповідними тензорами. На основі елементів симетрії можна передбачити наявність або відсутність тих або інших властивостей кристала. Багато їхніх властивостей (забарвлення, люмінесцентні властивості, міцність, пластичність та ін.) істотно залежать від типів і кількості дефектів.
За типом головного хімічного зв'язку виділяють йонні, ковалентні, молекулярні і металічні кристали.
Форма й чистота кристалу залежать від складу речовин, з яких вони утворюються (див. високочистий кристал), та умов кристалізації. Природні і синтетичні кристали застосовують в оптиці, різних галузях електроніки, радіотехніки, обчислювальної техніки, а також як надтверді абразивні матеріали і опорні елементи надточних приладів. Вивчає кристали кристалографія.
Кристал справжній (англ. real crystal) — природний кристал, форма якого залежить не тільки від внутрішньої будови, але і від зовнішніх умов росту.
Зональна будова — внутрішня будова кристалів, зумовлена чергуванням у них шарів різного складу, або різних властивостей. Залежить від зовнішньої форми кристалів та умов росту.
Класифікація кристалів
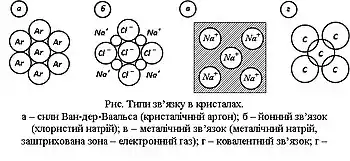
У фізиці твердого тіла за переважним типом хімічного зв’язку прийнята така класифікація кристалів :
– металічні (Na, Al, Cu, Ag, Zn, Fe та ін.);
– йонні (NaCl, MgO, LiF та ін.);
– ковалентні (C, Si та ін.);
– молекулярні (кристали багатьох органічних речовин).
Металічні кристали характеризуються специфічною електронною структурою, високою електро- і теплопровідністю.
Йонні кристали в структурному відношенні являють собою позитивні й негативні йони, що правильно чергуються. Сили притягання і відштовхування між йонами визначають стан рівноваги і характерні для кожного кристалу міжйонні відстані. Йонні кристали у більшості випадків є діелектриками, незначна електропровідність яких обумовлена дифузним переміщенням йонів. Йонний зв’язок утворюється завдяки переходу електронів від однієї хімічної складової кристала до іншої. У хімічних сполуках деякі атоми прагнуть захопити електрони та утворити негативні йони, тоді як інші атоми втрачають електрони і стають позитивними йонами. У наведеному ряду елементи розташовані таким чином, що в хімічних сполуках атоми, що стоять зліва, віддають електрони атомам, що стоять справа: Li, Rb, K, Ca, Na, Al, Zn, Cd, Sn, H, Cu, Hg, Br, Cl, F.
Ковалентні кристали представлені сполуками, хімічні зв’язки у яких обумовлюють спарені електрони. Такі кристали можна знайти серед органічних сполук, напівпровідників і діелектриків, у результаті чого електропровідність ковалентних кристалів змінюється в широкому діапазоні.
Молекулярні кристали утворюються у тих елементах або сполуках, для яких електронні переходи між атомами допустимі у малому ступені. Молекулярний зв’язок характерний для благородних газів, водню, кисню, метану та інших насичених молекул вуглеводнів у твердому стані. Молекулярним кристалам притаманні властивості ізоляторів.
Відмінності типів кристалів обумовлені різними зв’язками між елементами кристалу. Електростатичний (йонний) тип зв’язку в йонних кристалах (хлористий натрій), ковалентний зв’язок у великої групи кристалів, який здійснюється спареними електронами вуглецевих атомів (алмаз), сили Ван-дер-Ваальса, характерні для кристалів благородних газів й органічних сполук (напр., кристалічний аргон), і металічний зв’язок, що здійснюється електронним газом (кристали металів).
Монокристали і полікристали
Чимало речовин мають кристалічну структуру, хоча зазвичай не мають характерної для кристалів форми. До таких речовин належать, наприклад, метали. Дослідження показують, що такі речовини складаються із великої кількості дуже маленьких кристаликів — кристалічних зерен. Ці речовини також називають полікристалічними.
Якщо єдина кристалічна структура розповсюджується на все тіло, то таке тіло називають монокристалом.
Рідкі кристали
Рідкі кристали (рос. жидкие кристаллы, англ. liquid crystals, нім. flüssige Kristalle m pl) — специфічний стан речовини, якому властиві риси як рідини (текучість), так і кристалу (анізотропія властивостей).
Атомний кристал
Кристал, в якого головними є ковалентнi зв'язки мiж атомами, що стоять у вузлах ґраток (напр., алмаз). Характеризується високою твердiстю, малими електро- та теплопровiднiстями.
Елементи кристалу
Елементи кристалу (рос. элементы кристалла, англ. elements of crystal) — кути між кристалографічними осями й відношення відрізків, які відтинає на цих осях одиночна грань a0: b0: c0: = a0/b0: b0/b0: c0/b0 = a:1:c.
Елементи обмеження кристалу (рос. элементы ограничения кристалла, англ. crystal limiting elements) — грані, ребра і вершини, якими замикається простір кристала.
Симетрія кристалу
Симетрія, що зумовлена ґратчатою будовою кристалу — це регулярність у положенні та розташуванні граней та ребер кристала, а також розташування атомів у ньому. Елементами симетрії є площина симетрії, вісь симетрії та центр симетрії. Різні види симетрії кристалів описуються точковими й просторовими групами симетрії.
Проростання кристалів
Проростання кристалів (рос. прорастание кристаллов, англ. crystal intergrowth, нім. Kristallspriessen n) — двійникові утворення, в яких індивіди взаємно перетинаються і пророщують один одного. Зовні пізнаються за наявністю вхідних кутів. Синонім — проростання мінералів.
Розрізняють проростання графічне (взаємне проростання двох мінералів; мінерал включений в інший мінерал у вигляді окремих вростків, які за своєю формою нагадують клиноподібні знаки; обидва мінерали мають однакове оптичне орієнтування). Синонім — проростання письмове.
Гігантський молекулярний кристал
Кристал з гігантською за розмірами структурою, який складається з атомів, зв'язаних ковалентними зв'язками. Такі кристали відзначаються міцністю і високою температурою плавлення (напр., оксид алюмінію, алмаз).
Ковалентний кристал
Кристал, в якому в вузлах ґратки стоять атоми, ковалентно зв'язані з іншими атомами в сусідніх вузлах ґратки.
Аксіаліт
У полімерних кристалах — багатошаровий агрегат, що складається з ламелярних кристалів, вивернутих зі спільного краю.
Кришталина
Стара українська назва кристалу.
Див. також
- Ламелярний кристал
- Елементарна комірка кристала
- Кристалічна ґратка
- Високочистий кристал
- Гігантський кристал
- Мікрокристали
- Монокристал
- Полікристал
- Кристал атомний (валентний)
- Кристал йонний
- Кристал металічний (метал)
- Кристал молекулярний
- Кристалізація
- Секторіальність (мінералогія)
- Антискелетні форми кристалів
- Форми кристалів
- Металічний кристал
- Молекулярний кристал
- Структура кристалів
- Хадакристали
- Відбитки кристалів
Джерело
- УСЕ. Універсальний словник-енциклопедія / Гол. ред. ради чл.-кор. НАНУ М. Попович. — Київ, «Ірина», 1999. -VII +1551с., іл.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
Література
- Вступ до теорії термодинамічних та кінетичних властивостей кристалів: Навч. посіб. для студ. / Я. С. Буджак, О. А. Бурий; Нац. ун-т «Львів. політехніка». — Л., 2000. — 150 c. — Бібліогр.: 15 назв.

