Едаравон
Едаравон — внутрішньовенний препарат, який використовується для лікування гострого інсульту[1] і бічного аміотрофічного склерозу (БАС).[2]
 | |
|---|---|
Едаравон
| |
| Систематизована назва за IUPAC | |
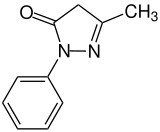
| 5-methyl-2-phenyl-4H-pyrazol-3-one | |
| Класифікація | |
| ATC-код | N07 |
| PubChem | |
| CAS | |
| DrugBank | |
| Хімічна структура | |
| Формула | C10H10N2O |
| Мол. маса | |
| Синоніми | MCI-186 |
| Фармакокінетика | |
| Біодоступність | |
| Метаболізм | |
| Період напіввиведення | від 4,5 до 6 годин |
| Екскреція | нирками |
| Реєстрація лікарського засобу в Україні | |
Медичне використання
Едаравон підтвердив свою ефективність щодо отримання сприятливого результату терапії у пацієнтів з гострим ішемічним інсультом. З 2009 року внесений в Японський гадлайн по лікуванню гострого ішемічного інсульту (рекомендація Grade B).[1]
Едаравон також зареєстрований для лікування бічного аміотрофічного склерозу (БАС) в Японії, США, Канаді, Італії, Південній Кореї.[2][3][4][5][6]
В Україні едаравон у 2018 році зареєстрований по обом показаням: гострий ішемічний інсульт і бічний аміотрофічний склероз.[7]
Едаравон був схвалений FDA для лікування БАС у США у 2017 році на основі невеликого рандомізованого контрольованого клінічного дослідження з пацієнтами, які мали ранню стадію ALS (стаж до 2-х років, об'єм форсованого видиху >80 %). Едаравон призначали таким пацієнтам при БАС протягом 6 місяців, і як результат оцінка прогресування хвороби за шкалою ALSFRS-R відрізнялася на 33 % на користь едаравону порівняно з оцінкою в групі порівняння. Ефективність едаравону при БАС у пацієнтів з усіма стадіями БАС у двох попередніх випробуваннях доведена не була.[2][3]
Вводиться шляхом внутрішньовенної інфузії.[8]
Безпечність застосування препарату у період вагітності не встановлена. Призначення препарату вагітним не бажано. Жінкам у період застосування препарату слід утримуватися від годування груддю, оскільки препарат проникає у грудне молоко.[8]
Побічні ефекти
Повідомлялося про наступні побічні ефекти з частотою принаймні на 2 % вище у пацієнтів, які отримували едаравон, ніж у групі плацебо: синці, порушення ходи, головний біль, запалення шкіри, екзема, проблеми з диханням, глюкозурія.[2]
Фармакологія
Едаравон є низькомолекулярним антиоксидантним засобом, який серед багатьох видів активних форм кисню цілеспрямовано взаємодіє з пероксильними радикалами. Завдяки своїй амфіфільності едаравон поглинає як жиро-, так і водорозчинні пероксильні радикали, передаючи радикалу електрон. Едаравон пригнічує окислення ліпідів шляхом поглинання водорозчинних пероксильних радикалів, що ініціюють ланцюгові хімічні реакції, а також жиророзчинних пероксильних радикалів, що підтримують даний ланцюг.[9]
Механізм дії едаравону при ішемічному інсульті спрямований на глутаматну ексайтотоксичність і запобігання кальцієвому інфлюксу. Доведено, що препарат зменшує: пошкодження гематоенцефалічного бар'єра; тенденцію до розвитку набряку мозку; міграцію нейтрофілів, впливаючи на вторинне запалення, а також на оксидативний і нітритний/нітратний стреси.[10]
Механізм, за допомогою якого едаравон може бути ефективним при БАС достеменно невідомий.[2] Препарат володіє антиоксидантними властивостями, і вважається, що окисний стрес є частиною процесу, який руйнує нейрони у людей з БАС.[3][9]
Період напіввиведення едаравону становить від 4,5 до 6 годин, а період напіврозпаду його метаболітів — від 2 до 3 годин. Він метаболізується до сульфатного кон'югату і кон'югату глюкуроніду, жоден з яких не є активним. В основному едаравон виділяється з сечею у вигляді кон'югату глюкуроніду.[2]
Історія
Дослідники вперше розробили поглинач вільних радикалів — едаравон в кінці 1980-х років як препарат для лікування інсульту. Кодзі Абе, нині професор в Університетській лікарні Окаяма в Японії, вперше запропонував використовувати едаравон для терапії гострого інсульту з метою запобігання набряку мозку.[11]
Едаравон був випущений на фармацевтичний ринок в 2001 році в Японії корпорацією Mitsubishi Pharma для лікування гострого ішемічного інсульту. Станом на сьогодні вже доступні генеричні препарати едаравону.[1][7][12]
Mitsubishi Tanabe в 2011 році розпочала III фазу клінічного випробування едаравону при БАС в Японії, і в червні 2015 року він був схвалений для використання в Японії при бічному аміотрофічному склерозі.[13]
У травні 2017 року внутрішньовенний едаравон був схвалений FDA для лікування пацієнтів з бічним аміотрофічним склерозом (БАС) у США.[14] FDA зробило запит до Mitsubishi Tanabe щодо проведення декількох додаткових досліджень для з'ясування ризиків розвитку раку і хвороби печінки.[15] Едаравон у вигляді пероральної форми TW001 (суміш едаравону і SBE-HP-βCD[16]) розробляється компанією Treeway для лікування БАС; станом на 2015 рік вона успішно завершила випробування фази I і отримала статус орфанного препарату в США та Європі.[17]
Суспільство і культура
Ціна на випущений в Японії едаравон в 2001 році була встановлена японським урядом на рівні 9 931 ієн / ампула.[18]
Коли едаравон зареєстрували в Японії для лікування БАС, його ціна становила $ 35,000 за річний курс; натомість ціна у США на старті продаж була близько 145 тисяч доларів на рік.[12] У США цей препарат був схвалений FDA для всіх пацієнтів з БАС, але не було чітко визначено, чи погодяться страховики платити за цей препарат всім пацієнтам з діагнозом БАС, чи тільки людьми з ранніми стадіями захворювання.[12][19]
Торговими назвами едаравону є Radicut, Radicava, в Україні — Ксаврон.[7]
Список літератури
- Tomogane, Yusuke; Kageyama, Hirohito; Uchida, Kazutaka; Shirakawa, Manabu; Egashira, Yusuke; Yamagami, Hiroshi; Sakai, Nobuyuki; Yoshimura, Shinichi та ін. (2015). Effect of Edaravone on Favorable Outcome in Patients with Acute Cerebral Large Vessel Occlusion: Subanalysis of RESCUE-Japan Registry. Neurologia medico-chirurgica (англ.) 55 (3). с. 241–247. ISSN 0470-8105. PMC PMC4533339. PMID 25739433. doi:10.2176/nmc.ra.2014-0219. Процитовано 3 травня 2019.
- US Label: Edaravone. FDA. May 2017. For label updates see FDA index page for NDA 209176
- Petrov, Dmitry; Mansfield, Colin; Moussy, Alain; Hermine, Olivier (22 березня 2017). ALS Clinical Trials Review: 20 Years of Failure. Are We Any Closer to Registering a New Treatment?. Frontiers in Aging Neuroscience 9. ISSN 1663-4365. PMC PMC5360725. PMID 28382000. doi:10.3389/fnagi.2017.00068. Процитовано 3 травня 2019.
- Inc, Mitsubishi Tanabe Pharma Canada. Mitsubishi Tanabe Pharma Canada Announces Canadian Authorization of Radicava™ (Edaravone) to Treat ALS. www.newswire.ca (англ.). Процитовано 12 лютого 2019.
- Sarà disponibile in Italia il Radicut (it-IT). Процитовано 12 лютого 2019.
- ALS Therapy Radicava Enters Early Access Program in Europe. ALS News Today (амер.). 24 травня 2018. Процитовано 12 лютого 2019.
- Препарат Ксаврон: нові можливості в лікуванні інсульту та БАС. health-ua.com. Процитовано 12 лютого 2019.
- Ксаврон - інструкція для застосування, ціна в аптеках | Tabletki.ua. tabletki.ua. Процитовано 12 лютого 2019.
- Watanabe, Kazutoshi (2018). Насколько эффективен эдаравон при лечении острого ишемического инсульта и бокового амиотрофического склероза? (російською). Міжнародний неврологічний журнал 6 (100). Процитовано 12 лютого 2019.
- Поліщук М.Є., Московко С.П., Міщенко В.М. (грудень 2018). Сучасні погляди на лікування ішемічного інсульту. Медична газета "Здоров'я України". Процитовано 12 лютого 2019.
- FDA Approves Edaravone as a Treatment for ALS. Research ALS (амер.). Архів оригіналу за 12 лютого 2019. Процитовано 10 травня 2017.
- Herper, Matthew. The First ALS Drug In 22 Years Is Approved -- And It Costs 4 Times What It Does In Japan. Forbes. Процитовано 10 травня 2017.
- Lane, EJ (20 квітня 2016). Mitsubishi Tanabe says ALS drug meets PhIII endpoint. FiercePharma (англ.).
- Commissioner, Office of the. Press Announcements - FDA approves drug to treat ALS. www.fda.gov (англ.). Процитовано 7 травня 2017.
- NDA 209176 Approval letter. FDA. 5 травня 2017.
- Rong, Wen-Ting; Lu, Ya-Peng; Tao, Qing; Guo, Miao; Lu, Yu; Ren, Yong; Yu, Shu-Qin (2014-2). Hydroxypropyl-sulfobutyl-β-cyclodextrin improves the oral bioavailability of edaravone by modulating drug efflux pump of enterocytes. Journal of Pharmaceutical Sciences 103 (2). с. 730–742. ISSN 1520-6017. PMID 24311389. doi:10.1002/jps.23807. Процитовано 12 лютого 2019.
- Edaravone oral (англ.). AdisInsight. Процитовано 13 травня 2017.
- Press release:Launching of RADICUT Injection. 30 mg. Mitsubishi-Tokyo Pharmaceuticals via Evaluate. 23 травня 2001.
- Grady, Denise (5 травня 2017). A Second Drug Is Approved to Treat A.L.S.. The New York Times. Процитовано 8 травня 2017.