Епоксиди
Епоксиди — це органічні сполуки, в яких до двох сусідніх атомів карбону приєднаний атом оксигену. Вони також є циклічними етерами.
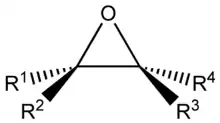
Будова
Цикл, що складається з двох атомів карбону та одного атома оксигену, є дуже напруженим, бо кути зв'язків становлять приблизно 60°, що значно відрізняється від тетраедричного кута (109,28°). У зв'язку з малим валентним кутом та полярністю зв'язку С-О у епоксидів, порівняно з ациклічними етерами, дуже великий дипольний момент.
Хімічні властивості
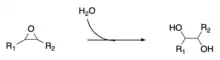
Епоксиди дуже легко реагують з сильними нуклеофілами. Зі слабкими нуклеофілами, як-от вода, епоксиди реагують при нагріванні. При взаємодії з водою завжди виходить транс-ізомер. Кислоти значно збільшують реакцієзадтність епоксидів, приєднуючи протон до атома оксигену. В безводному середовищві у присутності кислот Льюїса можуть димеризуватися, олігомеризуватися та полімеризуватися.
Отримання
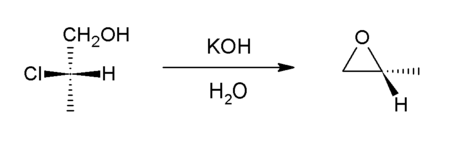
Епоксиди отримують взаємодією галогеналканолів або галогенциклоалканолів та сильних основ. Дегідрогалогенування галогеналканолів є прикладом реакції Вільямсона, оскільки атом оксигену заміщує атом хлору на сусідньому атомі карбону:
Найперспективнішим методом у отриманні епоксидів вважається окиснення алкенів. Окиснення може йти двома варіантами:
- Пряме окиснення. Застосовується у промисловості для отримання оксирану. Відбувається при температурі 300°С в присутності срібла:
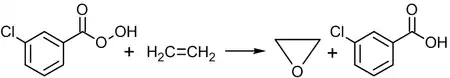
- Епоксидування. При реакції епоксидування алкен забирає атом оксигену з групи -OOH. Окисниками в цій реакції є гідропероксиди або надкислоти:
Література
О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
Ю. О. Ластухін, С. А. Воронов. Органічна хімія. Підручник для вищих навчальних закладів. — Львів: Центр Європи,2009.- 868 с. — ISBN 966-7022-19-6.