Алкени
Алке́ни (заст. олефіни) (рос. алкены, англ. alkenes, нім. Alkene, Alkylene) — ненасичені вуглеводні, що мають загальну формулу CnH2n. Алкени характеризує наявність подвійних зв'язків між атомами вуглецю; якщо подвійних зв'язків декілька, то такі сполуки називаються полієни.
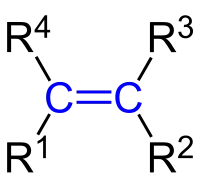
Алкени широко застосовуються для отримання полімерів, а також для синтезу похідних: дихлороетану, етиленгліколю, ізопропілового спирту, ацетону, акрилонітрилу й багатьох інших сполук, які мають велике значення.[1]
Історія відкриття
Вперше етилен був отриманий в 1669 німецьким хіміком і лікарем Бехером дією сірчаної кислоти на етанол. Вчений установив, що його «повітря» більш хімічно активне, ніж метан; однак, ідентифікувати отриманий газ він не зміг і назви йому не дав.[2]
Вдруге і тим же способом «повітря Бехера» було отримане й описане голандськими хіміками Дейманом, Потс-ван-Трооствіком, Бондом і Лауверенбургом в 1795. Вони назвали його «маслородним газом», оскільки при взаємодії з хлором, він утворював маслянисту рідину — дихлороетан (про це стало відомо пізніше).
Французький хімік Антуан Фуркруа ввів у практику термін «олефіни» (фр. oléfiant — «маслородний»), а коли були виявлені інші вуглеводні такого ж типу, ця назва стала загальною для всього класу сполук.[3]
На початку XIX століття французький хімік Ж. Гей-Люссак встановив, що етанол складається з «маслородного газу» й води. Цей же газ він виявив і в хлористому етилі.[4] У 1828 році Ж. Дюма і П. Булле припустили, що етилен являє собою основу, здатну давати солі подібно амоніаку. Якоб Берцеліус прийняв цю ідею, назвавши сполуку «етеріном» і позначивши буквою E[5].
Визначивши, що етилен складається з водню й вуглецю, довгий час хіміки не могли визначити його справжню формулу. У 1848 році Кольбе писав формулу етилену як С4Н4, цієї ж думки дотримувався й Лібіх. Ж. Дюма першим правильно визначив склад цієї речовини: С2НН3[4].
Будова
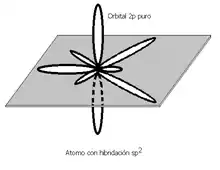
Атоми вуглецю, що зв'язані подвійним зв'язком, знаходяться у стані sp2-гібридізації. Подвійний зв'язок складається з одного σ-зв'язку, що утворився внаслідок перекривання sp2-орбіталій, та одного π-зв'язку, що утворився внаслідок перекривання негібридних p-орбіталей.
Енергія зв'язку C=C дорівнює 615 кДж/моль, що є менше, ніж енергія зв'язку двох одинарних зв'язків (енергія зв'язку С-С = 334 кДж/моль). Це вказує на те, що π-зв'язок менш міцний, аніж σ-зв'язок. Довжина подвійного зв'язку C–C (0,133 нм) менша, ніж довжина одинарного зв'язку C–C (0,154 нм).
Обертання атомів, пов'язаних подвійним зв'язком, ускладнене; для уможливлення обертання π-зв'язок має бути спочатку розірвано. Це пояснює стабільність цис- і транс-ізомерів: вони переходять одне в одного тільки при високій температурі або при фотохімічному збудженні (довжина електромагнітної хвилі зростає із кількістю кумульованих подвійних зв'язків, починаючи з ультрафіолетового випромінювання для алкенів з одним подвійним зв'язком і закінчуючи випромінюванням з видимого діапазону для полієнів).
Знаходження в природі й фізіологічна роль алкенів
У природі ациклічні алкени практично не зустрічаються[6]. Найпростіший представник цього класу органічних сполук — етилен (C2H4) — є гормоном дозрівання плодів і в незначній кількості синтезується, наприклад, цитрусовими.
Один з небагатьох природних алкенів — мускалур (цис-трикозен-9) є статевим атрактантом самки кімнатної мухи (Musca domestica).
![]()
Функцію сприйняття світла в людському оці виконує білок родопсин, що містить у собі зв'язану молекулу 11-цис-ретиналю.[7] При попаданні фотона світла на сітківку відбувається цис/транс-ізомеризація 11-цис-ретиналю до транс-ретиналю; це запускає ланцюг біохімічних процесів, які називаються зором.
Нижчі алкени у високих концентраціях володіють наркотичним ефектом. Вищі члени ряду також викликають судоми й роздратування слизових оболонок дихальних шляхів[8].
Окремі представники:
- Етилен — викликає наркоз, володіє дратівливою і мутагенною дією.
- Пропілен — викликає наркоз (сильніше, ніж етилен), викликає загальнотоксичну і мутагенну дію.
- Бутен-2 — викликає наркоз, володіє дратівливою дією[8].
Фізичні властивості
Перші три члени ряду олефінів є газами, далі йдуть рідини, що не змішуються з водою; вищі олефіни — це тверді речовини. Зі збільшенням молекулярної маси підвищуються температури плавлення і кипіння. Алкени нормальної будови киплять при більш високій температурі, ніж їх ізомери, що мають ізобудову. Температури кипіння цис-ізомерів вище, ніж транс-ізомерів, а температури плавлення — навпаки, що пов'язане з більш вираженим дипольним моментом перших.
Алкени погано розчиняються у воді (проте краще, ніж відповідні алкани), але добре — в органічних розчинниках.
| Назва | Формула | Температура плавлення, °C | Температура кипіння, °C | d204 | Агрегатний стан
при звичайній температурі |
| Етилен | C2H4 | -169,1 | -103,7 | 0,5700 | Газ |
| Пропен | C3H6 | -187,6 | -47,7 | 0,5193 | Газ |
| Бутен-1 | C4H8 | -185,3 | -6,3 | 0,5951 | Газ |
| Пентен-1 | C5H10 | -165,2 | +30.1 | 0,6405 | Рідина |
| Гексен-1 | C6H12 | -139,8 | 63.5 | 0,6730 | Рідина |
| Гептен-1 | C7H14 | -119 | 93,6 | 0,6970 | Рідина |
| Октен-1 | C8H16 | -101,7 | 121,3 | 0,7140 | Тверда речовина |
| Нонен-1 | C9H18 | -81,4 | 146,8 | 0,7290 | Тверда речовина |
Хімічні властивості
Алкени більш хімічно активні, ніж алкани, але менш активні, ніж алкіни.
Реакції з галогенами
Алкени вступають у реакції електрофільного приєднання з галогенами. Із хлором та бромом вони реагують наступним чином:[9]
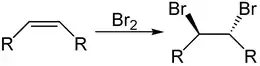
Ця реакція (на прикладі бромування) протікає у два етапи:
- ВЗМО алкену взаємодіє з НВМО молекули галогену (яку також можна представити у вигляді індукованого диполя), утворюючи катіон бромонію C2H4Br+ і бромід-аніон;
- Бромід-аніон атакує катіон бромонію за механізмом SN2:
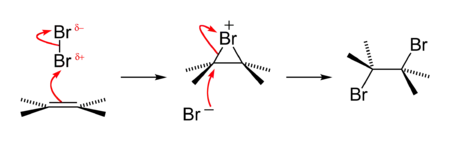 |
 |
|---|
Фтор є більш хімічно активним і тому реагує також із зв'язками С–Н і С–С, результуючи суміш різних флуорорганічних сполук. З йодом алкени реагують важко.
Реакції з галогеноводнями
Також вступають у реакцію з водними розчинами галогеноводнів:
Ця реакція теж іде у два кроки:
- Спочатку протон приєднується до молекули алкену, утворюючи карбокатіон;
- Карбокатіоновий інтермедіат реагує з галогенід-йоном, утворюючи кінцевий продукт:
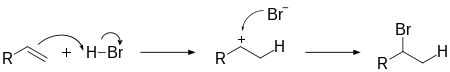
Регіоселективність цієї реакції визначається правилом Марковникова; тобто, з двох можливих регіоізомерв переважно утворюється той, де атом галогену зв'язаний з тим атомом вуглецю, що має більше зв'язків C–C, бо саме в цій позиції відбувається краща стабілізаціякарбокатіонового інтермедіату.
У присутності органічних пероксидів
У присутності органічних пероксидів приєднання галогеноводнів призводить до утворення анти-марковниковського продукту:
- 1. Спочатку бромоводень розпадається на радикали:
- 2. Радикал брома, що утворився, приєднується до алкену, утворюючи карборадикал:
- 3. Цей карборадикал взаємодіє з новою молекулою бромоводню:
Радикал брому, який утворився, взаємодіє з новою молекулою алкену і цикл повторюється; такі реакції називаються ланцюговими.
Каталітичне відновлення воднем
При взаємодії алкенів з воднем у присутності деяких d-елементів (напр. нікель, паладій або платина) утворюються алкани:
Реакції з водою
Реакції алкенів з водою відбуваються в кислотному середовищі (зазвичай, це розбавлені розчини сульфатної або нітратної кислоти):
Механізм реакції ідентичний до механізму реакції з галогеноводнями й також переважно результує марковниковські продукти:
Реакції з сульфатною кислотою
Алкени вступають у реакцію із сульфатною кислотою з утворенням алкілгідросульфатів:
Окиснення перманганатом калію
При окисненні алкенів гарячим розчином перманганату калію (альтернативно можуть бути використані нітратна кислота або дихромат калію) відбувається розрив подвійного зв'язку; продуктами реакції є альдегід/кетон і карбонова кислота:
У випадку термінальних алкенів замість кислоти утворюється діоксид вуглецю:
У цій реакції фіолетовий перманганат перетворюється на бурий нерозчинний оксид марганцю(IV), тому окиснення перманганатом може бути застосоване як якісна реакція на подвійний зв'язок.
Окиснення можна зупинити на стадії віцінального діолу, якщо використовувати холодний розчин перманганату калію:
Однак, більш надійним є застосування тетраоксиду осмію.
Віцінальне син-дигідроксилювання
Окиснення перманганатом можна зупинити на стадії віцінального діолу, якщо використовувати холодний розчин перманганату калію:
Однак, більш надійним є застосування тетраоксиду осмію:
Озоноліз
Окиснення озоном призводить до розриву подвійного зв'язку й утворення озонідів. При подальшому відновленні озонідів утворюються альдегід та/або кетон, за якими можна визначити алкен.
Алкен-галооксимне перетворення
(alkene-halooxime transformation)
Перетворення алкенів у галооксими типу >C=CH– → >CCl–C(=NOH)–
Отримання
Нижчі представники алкенів (наприклад, етилен і пропілен) отримують з фракцій при крекінгу нафти.
В органічному синтезі для отримання олефінів широко застосовуються реакції олефінування, в результаті яких утворюється новий подвійний зв'язок за рахунок взаємодії карбонільної сполуки (альдегіду або кетону) з карбаніоном або його еквівалентом. Найвідомішою серед реакцій олефінування є реакція Віттіга. Також широко застосовуються реакції Жуліа, Хорнера-Водсворта-Еммонса, Петерсона.
Алкени також можуть бути отримані при реакції «обміну» олефінів — реакція метатезису.
Алкени можна отримати за допомогою дегідрогенізації алканів. Реакція іде при нагріванні з оксидом хрому(III).
Також можуть бути отримані за допомогою дегідрації одноатомних спиртів при нагріванні у сульфатній кислоті:
Можуть бути отримані дегідрогалогенуванням галогеналканів:
Дегалогенування галогеналканів з двома атомами галогену:
Ще можуть бути отримані відновленням алкінів:
Примітки
- Конкин А. А., Зверев М. П. Полиолефиновые волокна, Изд.: «Химия», Москва, 1966. С.:280 (с.:13)
- Случайные открытия. Этилен. Занимательная химия. Архів оригіналу за 19 травня 2007.
- Открытие этилена (pdf). Открытия в органической химии и биохимии. Единая коллекция цифровых образовательных ресурсов. Архів оригіналу за 23 червня 2013.
- Меншуткин Н. Очеркъ развитія химическихъ воззрҌній. — С-Петербургъ: Тип. В.Демакова, 1888. — С. 252—264.
- Фигуровский Н. А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. — М.: Просвещение, 1979. — С. 102.
- У природі існує велика кількість сполук з подвійними зв'язками, наприклад терпени або каротиноїди, однак їх відносять до окремих класів сполук та у цій статті вони не розглядаються.
- Atkins, P. W. (Peter William), 1940-; Keeler, James,. Atkins' Physical chemistry (вид. Eleventh edition). Oxford, United Kingdom. ISBN 978-0-19-876986-6. OCLC 1020028162.
- Вредные вещества. Непредельные углеводороды этиленового ряда (алкены). Новый справочник химика и технолога. Chemanalytica.com. Архів оригіналу за 22 серпня 2011. Процитовано 22 липня 2009.
- Clayden, Jonathan. Organic chemistry. ISBN 978-0-19-166621-6. OCLC 867050415.
Джерела
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Дмитрий Григорьевич Кузнецов Органическая химия 13358K, 556 с. издание 2016 г.
- Vollhardt, Kurt Peter C. 1946-. Organic chemistry : structure and function (вид. Eighth edition). New York, NY. ISBN 978-1-319-18771-2. OCLC 1026984759.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.