Етери
Ете́ри або прості́ ефі́ри — органічні речовини, молекули яких складаються з двох вуглеводневих радикалів, сполучених між собою атомом кисню. Більшість всіх етерів — рідини, майже нерозчинні у воді. Найважливішим з етерів є діетиловий етер (С2Н5)2О — легкорухлива рідина з характерним запахом, що кипить при 35,6°. Він широко застосовується в лабораторній практиці як розчинник, а в медицині — для наркозу і як складова частина деяких ліків.
Методи синтезу
Дегідратацією спиртів зручно одержувати симетричні етери. Реакцію проводять в присутності кислотних водовідбирних реагентів, наприклад сульфатної кислоти чи Р2О5:
Взаємодією алкоголятів з галогенпохідними вуглеводнів або диалкілсульфатами одержують несиметричні етери (реакція Вільямсона):
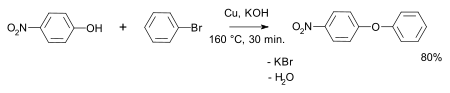
Найкращі виходи спостерігаються при використанні первинних галогенпохідних (вторинні та третинні галогенпохідні вступають до реакції елімінування з утворенням алкенів). Ароматичні галогенпохідні погано вступають до цієї реакції; для одержання змішаних етерів з ароматичним фрагментом використовують взаємодію феноляту з аліфатичним галогенпохідним. Для одержання етерів з двома арильними фрагментами використовують конденсацію Ульмана — взаємодію феноляту з ароматичним галогенпохідним в присутності порошку міді[1]:
Реакцією спиртів з електронодефіцитними алкенами:
Дана реакція потребує кислотного каталізу. Також як каталізатор використовують Hg(OCOCF3)2. На цій реакції базується використання дигідропірану для захисту спиртових груп.
Хімічні властивості
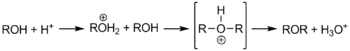
Внаслідок неподіленої пари електронів у атома оксигену етери проявляють основні властивості, приєднуючи протон. В результаті утворюються оксонієві солі. Вони є нестійкими та можуть розпастися або гідролізуватися.
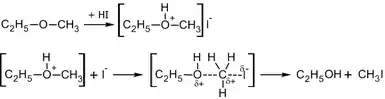
При взаємодії з галогенами утворюють галогенпохідні ефірів:
Ці галогенпохідні можуть вступати у реакцію з сильними нуклеофілами, наприклад, СN-:
Вони також можуть вступати у реакції дегідрогалогенування:
Окиснення ефірів протікає під дією ультрафіолетового випромінювання. В результаті утворюються різні продукти, включаючи пероксиди:
Взаємодіють з лужними металами з утворенням алкоголятів та металоорганічних сполук:
Див. також
Примітки
- Fritz Ullmann, Paul Sponagel (1905). Ueber die Phenylirung von Phenolen. Berichte der deutschen chemischen Gesellschaft 38 (2): 2211–2212. doi:10.1002/cber.190503802176.
Джерела
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4
- Кузнецов Д. Г. Органическая химия: Учебное пособие. — СПб.: Издательство «Лань», 2016. — 556 с. ISBN 978-5-8114-1913-5
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
Посилання
- ЕТЕРИ //Фармацевтична енциклопедія
- Ефір // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.