Етилендіамінтетраоцтова кислота
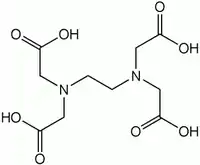
Етилендіамінтетраоцтова кислота (ЕДТА від англ. EDTA) — органічна сполука, чотириосновна карбонова кислота з хімічною формулою (HOOCCH2)2N(CH2)2N(CH2COOH)2, білий дрібнокристалічний порошок, малорозчинний у воді, не розчиняється в більшості органічних розчинників, розчинний у лугах, з катіонами металів утворює солі етилендіамінтетраацетат. Отримують шляхом конденсації етилендіаміна з монохлороцтовою кислотою.
| Етилендіамінтетраоцтова кислота | |
|---|---|
 | |
| Ідентифікатори | |
| Абревіатури | EDTA, ЕДТА |
| Номер CAS | 60-00-4 |
| PubChem | 6049 |
| Номер EINECS | 200-449-4 |
| DrugBank | 00974 |
| KEGG | D00052 |
| Назва MeSH | D02.092.782.258.368.250 і D02.241.081.018.253 |
| ChEBI | і 42189 42191 і 42189 |
| RTECS | AH4025000 |
| SMILES |
OC(CN(CC(O)=O)C-CN(CC(O)=O)CC(O)=O)=O |
| InChI |
1S/C10H16N2O8/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20/h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20) KCXVZYZYPLLWCC-UHFFFAOYSA-N |
| Номер Бельштейна | 1716295 і 3914756 |
| Номер Гмеліна | 144943 |
| Властивості | |
| Молярна маса | 292,2438 г/моль |
| Густина | 0,86 г/см³ |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Синоніми і скорочення: комплексон II.
Застосування
Застосовують ЕДТА у вигляді дигідрату двонатрієвої солі (комплексон III, трилон Б, Na2-ЕДТА) — у текстильній, шкіряній, паперовій, лакофарбовій промисловості, у виробництві металів, каучука, у кольоровій кінематографії, для пом'якшення води. В аналітичній хімії ЕДТА дозволяє визначати більше 60 елементів. У медицині ЕДТА використовують для виведення з організму радіоактивних і токсичних металів, для консервації крові та ін. У токсикології кобальтові солі ЕДТА використовуються як антидот у разі отруєння синильною кислотою або хлорціаном. У стоматології використовується під час ендодонтичної обробки каналів зуба. Для підвищення ефективності проходження кореневого каналу він розм'якшує поверхневий дентин. У фармацевтичних технологіях ЕДТА застосовують для посилення проникності ліків через слизові оболонк[1].
Також застосовується у сільському господарстві як добриво (так звані елементи у хелатній формі). Хелатна форма поживних елементів добре засвоюється рослинами, як у разі кореневого, так і листового підживлення[].
У молекулярній біології ЕДТА використовується в розчинах для зберігання ДНК, оскільки пригнічує дію багатьох металозалежних нуклеаз[].
Побічні й негативні дії ЕДТА
-ion.png.webp)
ЕДТА проявляє низьку гостру токсичність при ЛД50 (щури) від 2,0 г/кг до 2,2 г/кг.[2]Було виявлено, що вона є цитотоксичною і в незначній мірі генотоксичною (виявлено в результаті дослідів на лабораторних тваринах). Відзначається, що пероральне введення призводить до змін у репродуктивній системі й загальному розвитку.[3]
Вплив на довкілля
ЕДТА має настільки широке застосування, що піднімається питання, чи є цей органічний забруднювач стійким. Хоча ЕДТА має багато важливих функцій у різних промислових, фармацевтичних та інших напрямках, екологічна тривалість ЕДТА може викликати серйозні проблеми в навколишньому середовищі. Розпад ЕДТА відбувається повільно. В основному це відбувається абіотично під дією сонячних променів.[4]
Найважливішим процесом для усунення ЕДТА з поверхневих вод є прямий фотоліз при довжинах хвиль нижче 400 нм.[5] Багато комплексів ЕДТА (такі як Mg2+ і Ca2+) у природі зустрічаються в надмірній кількості і є стійкими.
Дослідження також показують, що ЕДТА негативно впливає на родючість ґрунтів і врожайність сільськогосподарських культур.[6] Оскільки ЕДТА збільшує рухливість важких металів, їх вплив негативно позначається і на стані ґрунтової мікрофлори, що у свою чергу негативно впливає на родючість ґрунту.
Зазвичай рослини майже не засвоюють токсичні для них важкі метали, але з огляду на те, що ЕДТА виконує функцію транспортного агента, ці комплекси потрапляють в організм рослини і призводять до порушення процесів у клітинах, а отже впливають на ріст і розвиток рослини в цілому. Зокрема, було виявлено, що в результаті потрапляння надлишкової кількості важких металів у рослину може виникати хлороз, уповільнення ростових процесів, порушення метаболізму і зниження здатності фіксувати молекулярний азот у бобових культур. Важкі метали накопичуються в рослинах, а в подальшому і в сільськогосподарській продукції, впливаючи на її якість.[7]
Див. також
- Комплексонометрія
Примітки
- Peter W. J. Morrison, Vitaliy V. Khutoryanskiy. . — Т. 472. — DOI:.
- Hart, J. Roger (2005). Ethylenediaminetetraacetic Acid and Related Chelating Agents. doi:10.1002/14356007.a10_095.
- Lanigan, R. S.; Yamarik, T. A. (2002). Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA. International Journal of Toxicology. 21 Suppl. 2 (5): 95–142. PMID 12396676. doi:10.1080/10915810290096522.
- Bucheli-Witschel, M.; Egli, T. (2001). DAB: Environmental Fate and Microbial Degradation of Aminopolycarboxylic Acids. FEMS Microbiology Reviews 25 (1): 69–106. PMID 11152941. doi:10.1111/j.1574-6976.2001.tb00572.x.
- Kari, F. G. (1994). Umweltverhalten von Ethylenediaminetetraacetate (EDTA) under spezieller Berucksuchtigung des photochemischen Ab-baus. (PhD). Swiss Federal Institute of Technology.
- http://agropravda.com/news/chimia-dla-rasteniy/11521-primenenie-edta-v-selskom-hozjajstve
Література
- Темкина У. Я., Дятлова Н. МА. Этилендиаминтетрауксусная кислота // Хімічна енциклопедія: у 5 т / Зефиров Н. З. (гл. ред.). — МА.: Велика Російська енциклопедія, 1998. — Т. 5: Триптофан—Ятрохимия. — З. 498. — 783 з. — 10 000 экз. — ISBN 5-85270-310-9.
Посилання
- Этилендиаминтетрауксусная кислота. Большая Российская Энциклопедия. Министерство культуры Российской Федерации. Процитовано 7 лютого 2019.
- pH-Spectrum of EDTA complexes
- EDTA: Molecule of the Month
- https://web.archive.org/web/20061029103725/http://www.chem.utk.edu/~chem319/Experiments/Exp6.pdf
- Застосування ЕДТА у сільськім господі