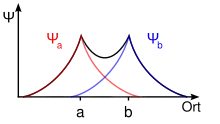
Зв'язуюча молекулярна орбіталь
Зв'язуюча молекулярна орбіталь — молекулярна орбіталь, що утворюється комбінацєю атомних орбіталей за теорією методу МО ЛКАО з виділенням енергії та зростанням хвильової функці, що супроводжується підвищенням електронної густини. У теорії МО електрони описуються хвильовою функцією[1]. Коли такі хвилі знаходяться близько і в одній фазі (синфазні, знаки функцій рівні), це приводить до їх комбінації (взаємодії) і нового, стабільнішого від попередніх станів, утворення. Таким чином формується стабільний зв'язок між цими двома атомними орбіталями[2].
Опис
За методом МО ЛКАО хвильова функція , що відповідає молекулярній орбіталі (МО), є лінійною комбінацією (сумою) функцій атомних орбіталей (АО):
- ,
або - ,
де n — кількість атомів у молекулі, , ,… хвильові функції електронних орбіталей атомів, що взаємодіють, с- числові коефіцієнти, які визначають несок кожної АО у МО і які визначають з огляду на умову мінімуму енергії. У разі додавання (+) , ... (знаки обох функцій додатні), хвильова функція зростає, тобто в просторі між ядрами з'являється ділянка підвищеної електронної густини, що стягує ядра і забезпечує хімічний зв'язок. На такій МО електрон матиме меншу енергію, як на початковій АО.
Диатомна молекула
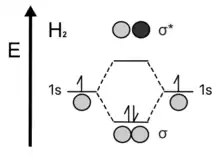
Класичним випадком є утворення двоатомної молекули водню H2 з атомів гідрогену у яких атомні орбіталі є ідентичними. При утворенні молекули дигідрогену H2 можливі два сценарійї утворення МО: накладання валентних орбіталей 1s, що знаходяться у однаковій фазі і що приводить до утворення (концентрування) електронної густини між ядрами атомів, або якщо АО різні за фазами, то це приведе до розпорошення (розпушування) електронної густини навколо атомів. Зв'язуючі орбіталі (σзв(1s)) приводять до утворення стабільної двоатомної молекули водню. Два електрони 1s із двох атомів гідрогену разом заповнюють зв'язуючу МО молекули водню. Розпушуючі орбіталі (σ*(1s)) — нестабільні і не приводять до зв'язування обох протонів, що мають однаковий заряд, оскільки електронна густина між ними у цьому випадку є незначною[3]. У другому випадку необхідна також і додаткова енергія, щоби тримати обидва атоми за допомогою розпушуючої орбіталі.
Примітки
- Mulliken, Robert S. (1932). Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations. Physical Review 41 (1): 49–71. doi:10.1103/physrev.41.49.
- Sannigrahi, A. B.; Kar, Tapas (1 серпня 1988). Molecular orbital theory of bond order and valency. Journal of Chemical Education 65 (8): 674. ISSN 0021-9584. doi:10.1021/ed065p674.
- Lennard-Jones, J. E. (1 січня 1929). The electronic structure of some diatomic molecules. Transactions of the Faraday Society (англ.) 25: 668. ISSN 0014-7672. doi:10.1039/tf9292500668.
Джерела
В. В. Григор'єва, В. М. Самійленко, А. М. Сич. Загальна хімія. Київ. Вища школа. 1991. ст. 87-89. ISBN 5-11-003667-5