Клатрин
Клатрин — це білок, який відіграє одну з найважливіших ролей в утворенні везикул в клітині. Клатрин був відкритий Барбарою Персі (англ. Barbara Pearse) в 1975 році.[1] Цей білок утворює структури, які нагадують трискеліон і складаються з трьох «важких» і трьох «легких» ланцюгів клатрину. Клатринові трискеліони можуть асоціюватись між собою, утворюючи полігональну решітку, яка заключає в собі везикулу. Звідси походить назва білка, оскільки латиною clatratus означає «решітка». Оболонкові протеїни, такі як клатрин, беруть участь у формуванні везикул всередині клітини. Екзоцитоз та ендоцитоз везикул дозволяє клітинам комунікувати між собою, переносити поживні речовини та сигнальні молекули, та інше. Процес ендоцитозу може бути використаний патогенами, такими, як віруси, для проникнення всередину клітини.[2]
Структура
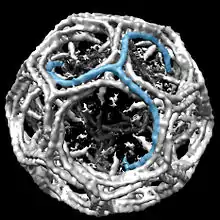
Клатриновий трискеліон побудований з трьох «важких» клатринових поліпептидних ланцюгів, які взаємодіють своїми C-кінцями, кожна масою ~190 kDa, а також трьома «легкими» поліпептидними ланцюгами масою ~25 kDa, що міцно зв'язані з важкими. Важкі ланцюги є основою клатринових ґраток, тоді як легкі ланцюги більше задіяні в регуляції зборки та розборки цілої клатринової комірки. Клатринові легкі ланцюги можуть існувати у вигляді двох форм, які позначаються a і b. Важкий ланцюг клатрину, кодований геном на хромосомі 17 в людини, експресується в усіх тканинах. Інший ген, що кодує важкий ланцюг, розташований на хромосомі 22, експресується в м'язах.
N-термінальний домен важкого ланцюга клатрину закінчується семікінцевою β-пропелерною структурою, завдяки якій відбувається взаємодія з іншими білками. Видовжена частина клатрину утворена суперспіралізованими альфа-спіралями.
Коли клатринові трискеліони взаємодіють між собою в розчині, видовжені домени мають певний запас гнучкості для утворення шестикутних та п'ятикутних фрагментів, які необхідні для збірки тривимірної комірки. коли багато трискеліонів об'єднуються між собою, може утворитись корзиноподібна структура. На малюнку вище зображена така структура, утворена з тридцяти шести трискеліонів, один з яких показаний блакитним кольором. Іншою типовою тривимірною формою утвореною клатрином є зрізаний екосаедр.
В клітині клатриновий трискеліон в цитоплазмі взаємодіє з адапторним протеїном на мембрані. Клатрин не може взаємодіяти з мембраною або везикулою напряму, і тому потребує протеїн-адаптор. Декілька мембранасоційованих клатринів можуть взаємодіяти між собою, поступово складаючись у жорстку тривимірну структуру, складену з п'ятикутників та шестикутників, що змушує мембрану викривлятись. Різні комбінації п'яти- й шестисторонніх з'єднань дають змогу отримати вигини різної форми та розмірів.
Функції
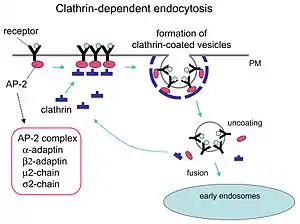
Клатин грає головну роль в процесі формування везикул. Клатринові везикули (англ. clathrin-coated vesicles, CCV) утворюються навколо різних молекул на клітинній мембрані, комплексу Гольджі та інших локаціях в клітині. Після доставлення везикули за призначенням клатринові молекули, які утворювали ґратку навколо неї, роз'єднуються, і молекули, що вивільнились, готові до утворення решітки навколо наступної везикули.
Процес утворення везикул неможливий без адапторних білків. Такими білками є, наприклад, AP180[3] та епсин.[4][5][6] AP180 бере участь у формуванні синаптичних везикул. Епсин залучає клатрин на мембрани та сприяє його полімеризації, а також сприяє викривленню мембрани.
Клатрин також має інші функції. В клітинах що не діляться, утворення клатринових везикул відбувається постійно. Цей процес повністю припиняється під час мітозу. В цей час клатрин асоціюється з веретеном поділу в комплексі з двома іншими білками: TACC3 та ch-TOG/CKAP5. Клатрин є допоміжним фактором в сегрегації хромосом за рахунок стабілізації кінетохорних мікротрубочок веретена поділу.[7][8]
Клатрин-опосередкований ендоцитоз (англ. clathrin-mediated endocytosis, CME) регулює багато фізіологічно-важливих процесів, таких як: інтерналізація рецепторів, проникнення патогенів, або синаптична передача сигналів.
Див. також
Посилання
- Pearse BM (April 1976). Clathrin: a unique protein associated with intracellular transfer of membrane by coated vesicles. Proceedings of the National Academy of Sciences of the United States of America 73 (4). с. 1255–9. PMC 430241. PMID 1063406. doi:10.1073/pnas.73.4.1255.
- https://www.ebi.ac.uk/interpro/potm/2007_4/Page1.htm
- McMahon HT. Clathrin and its interactions with AP180. MRC Laboratory of Molecular Biology. Архів оригіналу за 1 травня 2009. Процитовано 17 квітня 2009. «micrographs of clathrin assembly»
- McMahon HT. Epsin 1 EM gallery. MRC Laboratory of Molecular Biology,. Архів оригіналу за 2 січня 2009. Процитовано 17 квітня 2009. «micrographs of vesicle budding»
- Ford MG, Pearse BM, Higgins MK, Vallis Y, Owen DJ, Gibson A, Hopkins CR, Evans PR, McMahon HT (February 2001). Simultaneous binding of PtdIns(4,5)P2 and clathrin by AP180 in the nucleation of clathrin lattices on membranes. Science 291 (5506). с. 1051–5. PMID 11161218. doi:10.1126/science.291.5506.1051. Архів оригіналу за 21 листопада 2008. Процитовано 30 березня 2016.
- Higgins MK, McMahon HT (May 2002). Snap-shots of clathrin-mediated endocytosis. Trends in Biochemical Sciences 27 (5). с. 257–63. PMID 12076538. doi:10.1016/S0968-0004(02)02089-3. Архів оригіналу за 21 листопада 2008. Процитовано 30 березня 2016.
- Royle SJ, Bright NA, Lagnado L (April 2005). Clathrin is required for the function of the mitotic spindle. Nature 434 (7037). с. 1152–1157. PMC 3492753. PMID 15858577. doi:10.1038/nature03502.
- Hood FE, Williams SJ, Burgess SG, Richards MW, Roth D, Straube A, Pfuhl M, Bayliss R, Royle SJ (August 2013). Coordination of adjacent domains mediates TACC3-ch-TOG-clathrin assembly and mitotic spindle binding. J Cell Biol 202 (3). с. 463–78. PMC 3734082. PMID 23918938. doi:10.1083/jcb.201211127.