Молібдати
У хімії молібдат - це сполука, що містить оксоаніон з молібденом у найвищому ступені окислення 6. Молібден може утворювати дуже великий спектр таких оксоаніонів, які можуть бути дискретними структурами або полімерними розширеними структурами, хоча останні зустрічаються лише у твердому стані. Більш великі оксоаніони є членами групи сполук, що називаються поліоксометалатами, і тому, що вони містять лише один тип атома металу, часто називають ізополіметалатами. Окремі оксоаніони молібдену варіюються за розмірами від найпростішого у молібдаті калію аж до надзвичайно великих структур, виявлених у ізополі-молібденових синях, які містять, наприклад, 154 атоми Mo. Поведінка молібдену відрізняється від інших елементів групи 6. Хром утворює лише хромати, іони , , та , які засновані на тетраедричному хромі. Вольфрам схожий на молібден і утворює багато вольфраматів, що містять 6 атомів вольфраму.
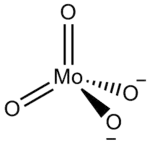
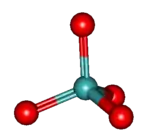
Приклади молібдатних аніонів
Прикладами молібдатних оксоаніонів є:
- наприклад, Na2MoO4 та мінерал повеліт, CaMoO4;
- , як гідратований діамонієвий димолібдат[усталений термін?]. Безводна тетрабутіламонієва сіль також відома;[1]
- у солі етилендіаміну;[2]
- у калійній солі;[3]
- в солях аніліну ();[4]
- (гекса-молібдат) в солі тетраметиламонію;[5]
- у молібдаті амонію, (NH4)6Mo7O24·4H2O;[6]
- у солі триметиламонію.
Іменування молібдатів, як правило, відповідає конвенції префіксу, щоб показати кількість присутніх атомів Мо. Наприклад, димолібдат для 2 атомів молібдену; тримолібдат для 3 атомів молібдену тощо. Іноді окислювальний стан додають у вигляді суфіксу, наприклад у пентамолібдаті (VI). Іон гептамолібдат, , часто називають "парамолібдатом".
Список літератури
- V. W. Day; M. F. Fredrich; W. G. Klemperer; W. Shum (1977). Synthesis and characterization of the dimolybdate ion,. Journal of the American Chemical Society 99 (18): 6146. doi:10.1021/ja00460a074.
- Guillou N.; Ferey G. (August 1997). Hydrothermal Synthesis and Crystal Structure of Anhydrous Ethylenediamine Trimolybdate. Journal of Solid State Chemistry 132 (1): 224–227(4). Bibcode:1997JSSCh.132..224G. doi:10.1006/jssc.1997.7502.
- B. M. Gatehouse; P. Leverett (1971). Crystal structure of potassium tetramolybdate, , and its relationship to the structures of other univalent metal polymolybdates. J. Chem. Soc. A: 2107–2112. doi:10.1039/J19710002107.
- W. Lasocha; H. Schenk (1997). Crystal Structure of Anilinium Pentamolybdate from Powder Diffraction Data. The Solution of the Crystal Structure by Direct Methods Package POWSIM. J. Appl. Cryst. 30 (6): 909–913. doi:10.1107/S0021889897003105.
- S. Ghammami (2003). The crystal and molecular structure of bis(tetramethylammonium) hexamolybdate(VI). Cryst. Res. Technol. 38 (913): 913–917. doi:10.1002/crat.200310112.
- Howard T. Evans jr.; Bryan M. Gatehouse; Peter Leverett (1975). Crystal structure of the heptamolybdate(VI)(paramolybdate) ion, [Mo7O24]6−, in the ammonium and potassium tetrahydrate salts. J. Chem. Soc., Dalton Trans. (6): 505–514. doi:10.1039/DT9750000505.
