Ступінь окиснення
Сту́пінь оки́снення — умовний електростатичний заряд, який приписують атому в молекулі, припускаючи, що електронні пари, які утворюють зв'язок, повністю зміщені в бік більш електронегативних атомів (тобто вважаючи, що всі зв'язки даного атома мають 100% йонний характер). На відміну від валентності, яка позначає кількість утворюваних зв'язків і є натуральним числом, ступінь окиснення може мати позитивне, негативне, нульове або дробове значення.
Наприклад, у молекулі хлороводню HCl відбувається зміщення однієї електронної пари і ступінь окиснення для водню набуває значення +1, а для хлору -1. Що більше електронів переходять до іншого атома, то більшим стає ступінь окиснення. Загалом він може набувати значень від +8 (як для осмію в OsO4) до -4 (кремній у Mg2Si), однак кожен хімічний елемент має ряд характерних саме для нього значень ступеня окиснення. Атоми в найвищому ступені окислення можуть бути тільки окисниками, а в найнижчому — тільки відновниками.
Ступінь окиснення є суто формальною величиною, оскільки не описує характер взаємодії у зв'язку. Так, ступінь окиснення атома хлору в молекулах HCl та NaCl набуває в обох випадках значення -1, проте його ефективний заряд (справжній ступінь поляризації) є різним.
Визначення ступеня окиснення
.jpg.webp)
Кисень має типове значення -2, для кальцію, як лужноземельного елемента, ступінь окиснення набуває значення +2, а для хлору, виходячи з правила нейтральності загального заряду, — +5
Визначення ступенів окиснення у молекулі базується на порівнянні значень електронегативності для атомів. Так, позитивні значення ступенів окиснення мають ті атоми, які віддали свої електрони іншим атомам (зв'язувальна електронна хмара зміщена від них), а негативні значення ступенів окиснення мають ті атоми, які приєднали електрони від інших атомів (зв'язувальна електронна хмара зміщена до них). Наприклад, у сполуці MgO хімічний елемент Магній має позитивний ступінь окиснення +2, а Оксиген — негативний ступінь окиснення −2.
Враховуючи те, що більшість елементів має характерні ступені окиснення (це пов'язано з будовою їхніх електронних оболонок), можна вивести наступні правила обчислення ступенів окиснення:
- алгебраїчна сума ступенів окиснення всіх атомів у молекулі має дорівнювати нулю, у багатоатомних йонах сума ступенів окиснення всіх атомів дорівнює заряду йона.
- для одноатомних йонів ступінь окиснення дорівнює заряду йона.
- ступінь окиснення елементів у простих речовинах дорівнює нулю (за винятком озону).
- ступінь окиснення лужних металів дорівнює +1 (за винятком простих речовин і алкалідів);
- ступінь окиснення гідрогену дорівнює +1 (в більшості сполук) або −1 (в гідридах), 0 в молекулі Н2;
- Флуор в усіх сполуках має ступінь окиснення −1 (за винятком F2);
- ступінь окиснення Оксигену в сполуках, як правило, дорівнює −2. Виняток становлять флуориди Оксигену (+2), сполуки діоксигеніл-іона О+2 (+1/2), кисень О2 (0), пероксиди (−1), супероксиди (−1/2) та неорганічні озоніди (−1/3).
Часто ступінь окиснення не збігається із числом утворюваних зв'язків. Зокрема, для атома Берилію у молекулі BeF2 ступінь окиснення є рівним +2, тоді як його молекула є полімерною. Також варто пам'ятати, що фактичний заряд на атомі може не відповідати ступеню окиснення цього атома. Так, у амоній-іоні атом Нітрогену має заряд +1, проте ступінь окиснення −3.
На письмі ступінь окиснення зазначається над символом елемента або вгорі праворуч від нього:
- або
Коли в тексті (не у формулі) необхідно позначити ступінь окиснення елемента, його записують одразу після символу або назви елемента без пробілів у круглих дужках. Наприклад: Оксиген(−2), О(−2), Ферум(+3), Fe(+3) чи залізо(0), Fe(0).
Винятки
- Ступінь окиснення Сірки у складі піриту (персульфіду Заліза (ІІ)) FeS2 дорівнює (−1) (група S2−2 є аналогом пероксидної групи O2−2)
- У складі складних оксидів атоми одного і того ж елемента можуть мати різні ступені окиснення. Наприклад: у магнетиті (фераті (ІІІ) Заліза (ІІ)) Fe3O4 Залізо має ступені окиснення +2 і +3). При розв'язанні завдань, для яких має значення ступінь окиснення, формулу магнетиту слід записувати так: Fe+2(Fe+3O2)2 (представлення у вигляді солі) або FeO·Fe2O3 (представлення у вигляді складного оксиду). Іншими поширеними прикладами складних оксидів є сурик Pb3O4 (2PbO·PbO2) та манганцева шпінель Mn3O4 (Mn+2(Mn+3O2)2 або MnO·Mn2O3).
Ступінь окиснення в органічних речовинах
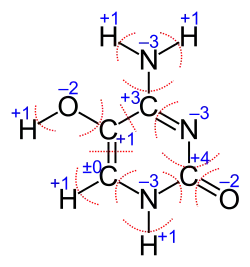
Поняття ступеня окиснення в органічній хімії використовується набагато рідше ніж в неорганічній. В органіці здебільшого прийнято оцінювати міру «окисненості» та «відновленості» сполуки за кількістю атомів кисню та водню в ній, відповідно. Однак, є кілька випадків, коли формалізм ступеня окиснення корисний і в органічній хімії: це реакції з перетворенням неорганічних сполук на органічні (і навпаки) та електрохімічні реакції (в яких варто знати кількість електронів, що беруть участь у кожній стадії процесу). В такому разі (на відміну від неорганічних сполук) найчастіше вираховують не середній ступінь окиснення елементу в сполуці, а ступінь окиснення кожного атома. При цьому вважається, що атом водню завжди має ступінь окиснення +1, а кисню — −2 (крім випадків перекисних сполук, в яких розглядають групу О2−2),[1] а ступінь окиснення відповідного атома вуглецю (Карбону) вираховується, виходячи з принципу електронейтральності[2].
Таким чином, найменший ступінь окиснення має атом вуглецю в метані C−4H4, а найвищий — у діоксиді вуглецю C+4O2 (продукті повного окиснення будь-якої органічної сполуки).
Для вуглеводнів ступінь окиснення атому вуглецю залежить від його зв'язності. В порядку зростання це:
- первинний атом вуглецю RC−3H3
- вторинний атом вуглецю RR'C−2H2
- третинний атом вуглецю RR'R"C−1H
- четвертинний атом вуглецю RR'R"R'"C0
Для кисневмісних сполук ступінь окиснення атому вуглецю залежить як від його зв'язності, так і від порядку зв'язку вуглець—кисень. В порядку зростання це:
- первинні спирти RC−1H2OH
- вторинні спирти RR'C0HOH
- формальдегід HC0(O)H
- третинні спирти RR'R"C+1OH
- альдегіди RC+1(O)H
- кетони RC+2(O)R'
- мурашина (форміатна) кислота HC+2(O)OH
- карбонові кислоти RC+3(O)OH та їх похідні (наприклад естери RC(O)OR' або ангідриди RC(O)OC(O)R')
Див. також
Примітки
- Правила обрахування ступенів окиснення інших гетероатомів набагато складніше і їх неможливо викласти в короткій статті. Варто тільки відмітити, що при цьому враховується, до якого класу сполук відноситься ця група.
- Тобто зв'язок СС будь-якого порядку вважається повністю неполярним, і «початковий» ступінь окиснення атомів вуглецю в ньому рівний нулю.
Джерела
- Глінка М. Л. Загальна хімія : підручник. — 2-ге вид., перероб. і доп. — Київ : Вища школа, 1982. — 608 с.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Романова Н. В. Загальна та неорганічна хімія: Підруч. для студ. вищ. навч. закл. — К., Ірпінь : ВТФ «Перун», 2004. — С. 100—102. — ISBN 966-569-106-6.
