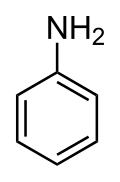
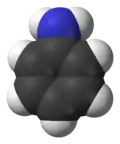
Анілін
Анілі́н (англ. Aniline, від ісп. añil - "індиго") — органічна сполука, найпростіший ароматичний амін. Свіжедистильований анілін – безбарвна або жовтувата олія, яка з часом доволі швидко окиснюється повітрям та набуває червоно-брунатного кольору.[4]
| Структурна формула | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | |||||||||||||||||||||||||||||||
| Загальна інформація | |||||||||||||||||||||||||||||||
| Преференційна назва ІЮПАК | Анілін | ||||||||||||||||||||||||||||||
| Систематична назва ІЮПАК | Амінобензен | ||||||||||||||||||||||||||||||
| Інші назви |
| ||||||||||||||||||||||||||||||
| Хімічна формула | C6H5NH2 | ||||||||||||||||||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||||||||||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Властивості | |||||||||||||||||||||||||||||||
| Молярна маса | 93.129 г·моль−1 | ||||||||||||||||||||||||||||||
| Агрегатний стан |
Рідина | ||||||||||||||||||||||||||||||
| Густина |
1.02 г·см-3 (20 °C)[1] | ||||||||||||||||||||||||||||||
| Температура плавлення |
-6 °C [1] | ||||||||||||||||||||||||||||||
| Температура кипіння |
184 °C [1] | ||||||||||||||||||||||||||||||
| Тиск насиченої пари |
68.1 Па (20 °C); 1.25 гПа (30 °C); 2.43 гПа (30 °C); 4.53 гПа (50 °C)[1] | ||||||||||||||||||||||||||||||
| pKa | |||||||||||||||||||||||||||||||
| pH розчину |
8.8 (H2O, 20 °C, нас.)[1] | ||||||||||||||||||||||||||||||
| Розчинність |
36 г·дм-3 (20 °C, H2O) | ||||||||||||||||||||||||||||||
| Діелектрична проникність (ε) |
6.89 | ||||||||||||||||||||||||||||||
| Коефіцієнт заломлення |
1,5863 (20 °C)[3] | ||||||||||||||||||||||||||||||
| В'язкість |
3.71 сП (3.71 мПа·с при 25 °C) | ||||||||||||||||||||||||||||||
| Термодинамічні властивості | |||||||||||||||||||||||||||||||
| ΔcH⦵298 |
−3394 кДж·моль-1 | ||||||||||||||||||||||||||||||
| Безпека | |||||||||||||||||||||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||||||||||||||||||||
| H-фрази | H: H301, H311, H331, H317, H318, H341, H351, H372, H400 | ||||||||||||||||||||||||||||||
| P-фрази | P: P273, P280, P302+P352, P304+P340, P305+P351+P338, P308+P310 | ||||||||||||||||||||||||||||||
| LD50 |
| ||||||||||||||||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||||||||||||||||||||
Анілін утворює солі з кислотами. Його основність значно зменшена через мезомерний ефект, який знижує електронну густину на аміногрупі.
Історія
Анілін вперше був ізольований Отто Унвердорбеном шляхом піролітичної дистиляції індиго та описаний 1826 році.[5] Через здатність утворювати кристалічні сполуки з кислотами він отримав назву "Кристалін" (нім. Crystallin); також автор зазначив, що ця сполука "пахне сильно, подібно до свіжого меду".
У 1834 році Фрідліб Рунге отримав анілін шляхом дистиляції кам'яновугільної смоли над оксидом міді й назвав його "Кіанол" (нім. Kyanol), або "Блакитна олія" (нім. Blauöl), бо отриманий продукт утворював із хлорним вапном стабільні сполуки блакитного кольору[6].
У 1840 році Карл Юліус Фріцше додав індиго в розчини їдкого калі та їдкого натру, а отриману після дистиляції сполуку назвав "Анілін" (нім. Anillin).[7]
У 1842 році Микола Зінін відновив нітробензен сірчистим амонієм (реакція Зініна); шляхом подальшої дистиляції він отримав олію, яку назвав "Бензідам" (нім. Benzidam). Зінін зазначив, що ця речовина "малорозчинна у воді, але змішується зі спиртом та ефіром", "має доволі гострий присмак, особливий запах, сполучається з усіма оксигеновмісними й безоксигеновими кислотами".[8]
У 1845 році А. В. Гофман ідентифікував продукти Фріцше й Зініна як ідентичні, віддавши перевагу терміну "Анілін"; він також описав реакцію відновлення нітробензену до аніліну за допомогою водню (цинк + кислота).[9][10]
З 1897 року Баденська анілінова та содова фабрика (BASF) використовує анілін у великих масштабах для синтезу індиго (синтез Гемана). Анілін також використовувався для синтезу багатьох інших барвників, тому його назва імплементувалась у назви інших сполук та навіть промислових термінів: аніліновий пурпур (став барвником, що поклав основу аніліновій фарбовій промисловості), анілінова шкіра (шкіра, що пофарбована розчинними пігментами, тому має фарбу по всьому об'єму, а не тільки на поверхні), аніліновий друк (друга назва флексографічного друку).
Отримання
У промислових масштабах анілін отримують шляхом гідрогенізації нітробензену при температурі 270 °С й 1,25 бар над мідним каталізатором на діоксиді кремнію.[11]
Раніше анілін отримували шляхом відновлення нітробензену залізом у присутності соляної кислоти (реакція Бешама):
Отриманий таким чином анілінгідрохлорид розкладали негашеним вапном.
Також отримують амінуванням хлоробензену — нуклеофільним заміщенням атома хлору на аміногрупу[12]:
Хімічні властивості
Солеутворення
Розчинність аніліну в воді незначна. Для сприяння або збільшення розчинності у воді анілін змішують з кислотою (наприклад, хлоридною), що призводить до негайного утворення солі. Зокрема, з соляною кислотою утворюється анілінгідрохлорид:
При нагріванні анілінгідрохлориду разом із аніліном утворюється діфеніламін:
Реакції з електрофільними групами
Аміногрупа аніліну є нуклеофільним центром, тому реагує з багатьма електрофілами.
Алкілюється спиртами, алкілгалогенідами та алкілсульфатами, утворюючі вторинні та третинні аміни.[13]
При реакції з хлоридами й ангідридами карбонових кислот анілін утворює аміди. Так, продуктом реакції аніліну з оцтовим ангідридом є N-фенілацетамід (ацетанілід):
, де позначає ацетил.
При реакції з альдегідами утворюються іміни:
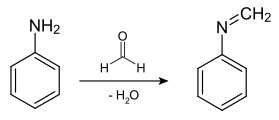
Зокрема, реакція аніліну з бензальдегідом призводить до бензиліденаніліну:

Може реагуваті з хлороформом в лужному середовищі, утворюючи фенілізоціанід:[13]
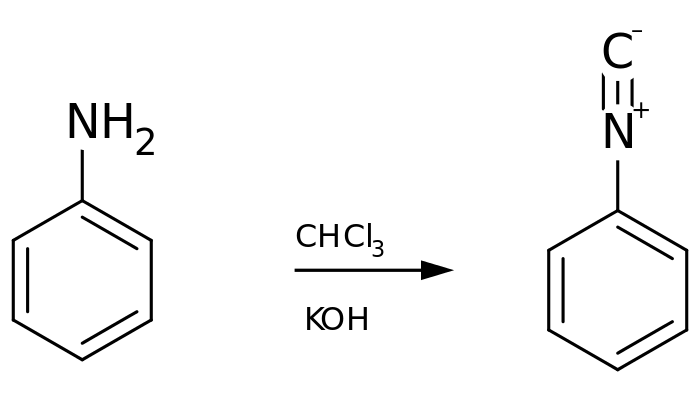
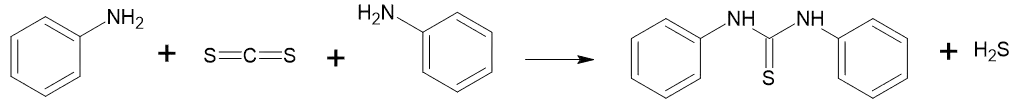
Взаємодія з карбон дисульфідом в лужному середовіщі дає дифенілтіосечовину.[13]
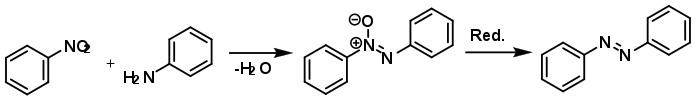
При реакції з нітросполуками утворюються азосполуки. Наприклад, анілін з нітробензеном дають азобензен:
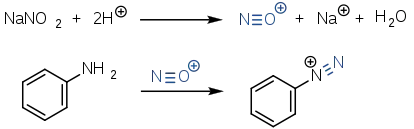
Анілін також є класичним субстратом, на прикладі якого пояснюється принцип реакції діазотування:
Окисно-відновні реакції
Аміногрупа аніліну може бути окиснена до нітрогрупи. Для цього можна застосувати такі окисники як пероксид водню, mCPBA, перманганат калію, оксид хрому(VI) або оксид свинцю(IV):
Така реакція може протікати й навпаки; якщо взяти, наприклад, нітроанілін і подіяти на нього відновником (наприклад, цинком у хлоридній кислоті, боргідридом натрію, алюмогідридом літію або сульфітом натрію), то можна отримати фенілендіамін:
Реакції ароматичного кільця
Оскільки аміногруппа є електронодонорним замісником на бензеновому кільці, анілін є дуже реактивною сполукою в реакціях електрофільного ароматичного заміщення. Тому часто реакцію важко контролювати; щоб отримати більший контроль, аміногрупу "деактивують", наприклад, шляхом утворення аміду:[14]
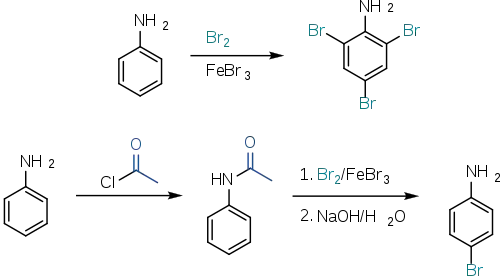
Окрім реакцій галогенування, як наведено вище, анілін вступає в інші реакції електрофільного заміщення, такі як реакція Фріделя–Крафтса й ацилювання за Фріделем–Крафтсом. Реакція сульфування на аніліні при 180 °C дає сульфанілову кислоту:
При конденсації з формальдегідом в присутності хлоридної кислоти утворюється 4,4-метилендіанілін.[13]
Якісні реакції на анілін
- взаємодія з хлорним вапном
- окиснення хромовою сумішшю
Безпека
Анілін – сильна отрута. Він окислює гемоглобін до метгемоглобіну і, таким чином, перешкоджає транспортуванню кисню в крові. При легкому отруєнні спостерігається посиніння шкіри і нігтів (ціаноз), запаморочення і збудження. У більш важких випадках виникають головні болі, втрата свідомості й задишка, яка може призвести до смерті. Тривала інтоксикація призводить до слабкості, втрати апетиту та може стати причиною раку сечового міхура.
У 1981 році анілін міг бути однією з причин масових отруєнь в Іспанії, спричинених забрудненою ріпаковою олією ("Іспанський олійний синдром").[15] Ріпакову олію денатурували аніліном для промислових цілей, а потім за непотрібністю передистилювали й продали вуличним торгівцям як «оливкову олію». В результаті 20 000 людей захворіли, понад 300 померли. На жаль, точні причини отруєння не були встановлені.
Див. також
Примітки
- Внесок про анілін в базі даних GESTIS.
- Evans pKa Table
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. p. 5–89. ISBN 978-1498754286.
- Ammon, Hermann P. T., 1933-; Hunnius, Curt, (2014). Hunnius Pharmazeutisches Wörterbuch : hrsg von Hermann P.T. Ammon ... (вид. 11., aktualisierte Aufl). Berlin: De Gruyter. ISBN 978-3-11-030990-4. OCLC 890518861.
- Otto Unverdorben: Ueber das Verhalten der organischen Körper in höheren Temperaturen, Annalen der Physik und Chemie, 1826, VIII, S. 397–410.
- F. F. Runge: Ueber einige Produkte der Steinkohlendestillation, Annalen der Physik und Chemie, 1834, XXXI, S. 65–78 (doi:10.1002/andp.18341070502).
- J. Fritzsche: Über das Anilin, ein neues Zersetzungsprodukt des Indigos, Annalen der Chemie, 1840, 36 (1), S. 84–90 (doi:10.1002/jlac.18400360108).
- Dr. N. Zinin: Beschreibung einiger neuer organischer Basen, dargestellt durch die Einwirkung des Schwefelwasserstoffes auf Verbindungen der Kohlenwasserstoffe mit Untersalpetersäure, Journal für praktische Chemie, 1842, S. 140–153 (doi:10.1002/prac.18420270125).
- A. W. Von Hofmann, J. S. Muspratt: Neue Bildungsweisen des Anilins, Annalen der Chemie, 1845, 53 (2), S. 221–229 (doi:10.1002/jlac.18450530206).
- A. W. von Hofmann: Über eine sichere Reaction auf Benzol, Liebigs Annalen, 1845, 55 (2), S. 200–205 (doi:10.1002/jlac.18450550205).
- H. Wittcoff et al.: Industrial Organic Chemicals. 2004, Chapter 7, S. 294.
- Ю.О. Ластухін, С.А. Воронов (2009). Органічна Хімія. Львів: Центр Європи. с. 664. ISBN 966-7022-19-6.
- Kahl, Thomas; Schröder, Kai-Wilfrid; Lawrence, F. R.; Marshall, W. J.; Höke, Hartmut; Jäckh, Rudolf (15 червня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Aniline. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a02_303. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_303.
- Vollhardt, Kurt Peter C.; Schore, Neil Eric. (2011). Organische Chemie (вид. 5., Auflage). Weinheim, Bergstr: Wiley-VCH. ISBN 3-527-32754-1. OCLC 760140825.
- E. Gelpí et al.: The Spanish Toxic Oil Syndrome 20 Years after Its Onset: A Multidisciplinary Review of Scientific Knowledge. In: Environmental Health Perspectives, 2002, 110 (5), S. 457–464, PMID 12003748; Повний текст на PMC: 1240833.