Міжатомна взаємодія
Міжатомна взаємодія — електромагнітна взаємодія електронів і ядра одного атома з електронами і ядром іншого атома. Міжатомна взаємодія залежить від відстані між атомами і конфігурації електронних оболонок атомів. Мірою міжатомної взаємодії є енергія взаємодії атомів. Енергія взаємодії атомів лежить в широкому діапазоні. Енергія міжатомної взаємодії є чітко вираженою періодичною функцією зарядового числа ядра атома.[1]
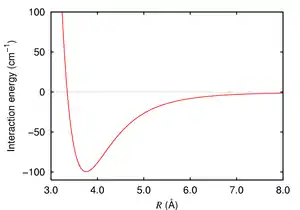
При високих значеннях енергії взаємодії між однаковими атомами відбувається утворення гомоядерних двохатомних молекул. При низьких значеннях енергії міжатомної взаємодії атоми зберігають свою індивідуальність, так всі благородні (інертні) гази (гелій, неон, аргон, криптон, ксенон, радон) при нормальних умовах моноатомні.[2] Проте енергія міжатомної взаємодії атомів благородних газів зумовлює можливість існування різних агрегатних станів благородних газів (газ, рідина і тверде тіло). Походження сил, що викликають притягання атомів один до одного, було пояснено в 1930 році Фріцом Лондоном. Міжатомне притягання виникає внаслідок флуктуації електричних зарядів у двох атомах, що знаходяться близько один від одного. Кожен атом володіє миттєвим електричним дипольним моментом, відмінним від нуля. Миттєвий дипольний момент на одному атомі наводить протилежно спрямований диполь у сусідньому атомі. Ці диполі притягуються один до одного за рахунок електростатичного притягання[3]. Міжатомна взаємодія проявляється при складанні з атомів наноматеріалів, атомних і молекулярних кластерів, фулеренів тощо.
Залежність від віддалі між атомами
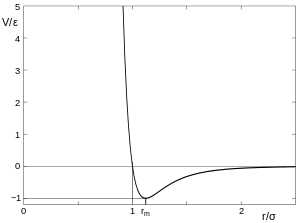
Потенціал взаємодії між нейтральними атомами на великих відстанях між ними завжди має характер притягання, спричинений вандервальсовими силами — взаємодією наведених дипольних моментів. Притягання відповідає негативному значенню енергії взаємодії. Чим далі атоми один від іншого — тим ближча енергія взаємодії до нуля. На дуже близьких відстанях між атомами вони відштовхуються у відповідності з принципом Паулі. Відштовхування відповідає позитивному значенню енергії взаємодії. На середніх відстанях потенціал взаємодії має мінімум, який приблизно відповідає середній відстані між атомами в конденсованих фазах: рідині та твердому тілі або в багатоатомних молекулах.
Глибина мінімуму й форма потенціальної кривої в його області залежить від можливості утворення хімічного зв'язку між атомами. При утворенні ковалентних зв'язків, для яких характерне насичення, міжатомна взаємодія перестає бути парною і центральною, тобто взаємодія між двома атомами залежить від присутності та положення інших атомів у складі молекули чи твердого тіла. У молекулі води, наприклад, атоми кисню та водню утворюють добре визначений кут 104,45o, і при відхиленні від цього значення кута виникають сили, що намагаються повернути атоми в стабільне положення.
Моделювання
Знання потенціалу міжатомної взаємодії важливе для молекулярної динаміки. Зазвичай використовуються модельні потенціали з параметрами, які підбираються емпірично таким чином, щоб описати фізичні властивості досліджуваних матеріалів. Дещо допомагають квантово-хімічні розрахунки, однак вони дають непогані результати тільки в певному діапазоні відстаней між атомами.
Для атомів, що не утворюють хімічних зв'язків популярними модельними потенціалами є потенціал Ленард-Джонса та потенціал Морзе. При утворенні хімічних зв'язків використовуються складніші нецентральні потенціали, наприклад, для моделювання взаємодії між атомами Карбону в полімерах або нанотрубках використовуються потенціал Терсоффа.[4] або потенціал Бреннера[5]
Примітки
- Некрасов Б. В. Курс загальної хімії.
- Химический энциклопедический словарь.
- Даниэльс Ф., Олберти Р. Физическая химия.
- Tersoff, J. (1988). Phys. Rev. B 37: 6991. Bibcode:1988PhRvB..37.6991T. doi:10.1103/PhysRevB.37.6991.
- Brenner, D. W. (1990). Phys. Rev. B 42 (15): 9458. Bibcode:1990PhRvB..42.9458B. doi:10.1103/PhysRevB.42.9458.
