Електронна конфігурація
Електро́нна конфігура́ція — формула розташування електронів на різних електронних оболонках атома хімічного елемента.
.png.webp)
З погляду квантової механіки, електронна конфігурація — це повний перелік одноелектронних хвильових функцій, із яких з достатнім рівнем точності можна скласти повну хвильову функцію атома (у наближенні самоузгодженого поля).
Електронна конфігурація атома значною мірою визначає його хімічні властивості.
Розрізняють:
- Для молекулярної частинки — розподіл електронів, згідно з принципом Паулі, між одноелектронними хвильовими функціями (молекулярними орбіталями). Хвильова функція для даної електронної конфігурації, що є власною функцією спінових операторів S2 та Sz представляє електронний стан молекули. При цьому можуть виникнути декілька електронних станів із різними мультиплетностями, наприклад, для молекули кисню характерними є синглетний та триплетний стани.
- Для атома — стан, що відповідає певному заселенню атомних орбіталей атома згідно з принципом побудови, правилом Гунда та принципом Паулі. Записується як послідовність чисел електронів на кожній орбіталі або підоболонці атома. Є декілька способів такого запису. Звичайно запис підоболонок (англ. subshell notation) реєструє підоболонки в порядку збільшення енергії та числа електронів у кожній підоболонці, що зазначається суперскриптом.
Нотація
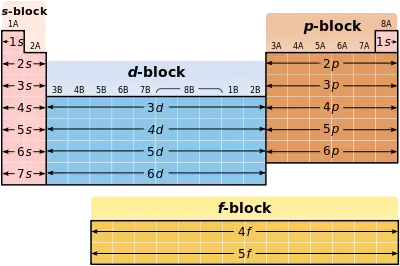
Для позначення електронної конфігурації хімічного елементу використовують назви орбіталей: s, p, d, f, g. Перед назвою орбіталі стоїть основне квантове число, а верхній індекс після позначення орбіталі вказує на те, скільки електронів є на орбіталях даного сорту.
Наприклад, для неону електронна конфігурація записується 1s22s22p6. Цей запис означає, що неон має два електрони на внутрішній s-орбіталі, 2 електрони на зовнішній s-орбіталі й 6 електронів на зовнішній p-орбіталі.
Для заліза електронну конфігурацію можна записати таким чином [Ar]3d64s2. Це означає, що внутрішні оболонки заліза заповнені так само, як у аргону, а решту 8 електронів розподілені так: d-оболонка заповнена не повністю, два електрони перебувають на зовнішній 4s-оболонці. На d-оболонці — 6 електронів (із можливих 10).
Розподіл електронів в атомі
Заповнення електронами атомних орбіталей підкоряється певним правилам:
- Правило Паулі (заборона Паулі). В атомі не може бути двох електронів з тотожними значеннями всіх чотирьох квантових чисел.
- Правило Хунда. При заповненні електронних підрівнів сумарне спінове число повинне бути максимальним. Тобто не може бути одночасно незаповненою хоча б одна комірка в підрівнях і два електрони в одній з них.
- Правило Клечковського. Заповнення електронних орбіталей відбувається згідно зростанню суми головного і орбітального квантових чисел. Якщо суми рівні, то заповнюється в першу чергу та орбіталь, в якої орбітальне квантове число менше.
| K | L | M | N | O | K | L | M | N | O | P | K | L | M | N | O | P | Q | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 41Nb | 2 | 8 | 18 | 12 | 1 | 81Tl | 2 | 8 | 18 | 32 | 18 | 3 | ||||||
| 2He | 2 | 42Mo | 2 | 8 | 18 | 13 | 1 | 82Pb | 2 | 8 | 18 | 32 | 18 | 4 | ||||||
| 3Li | 2 | 1 | 43Tc | 2 | 8 | 18 | 13 | 2 | 83Bi | 2 | 8 | 18 | 32 | 18 | 5 | |||||
| 4Be | 2 | 2 | 44Ru | 2 | 8 | 18 | 15 | 1 | 84Po | 2 | 8 | 18 | 32 | 18 | 6 | |||||
| 5B | 2 | 3 | 45Rh | 2 | 8 | 18 | 16 | 1 | 85At | 2 | 8 | 18 | 32 | 18 | 7 | |||||
| 6C | 2 | 4 | 46Pd | 2 | 8 | 18 | 18 | 0 | 86Rn | 2 | 8 | 18 | 32 | 18 | 8 | |||||
| 7N | 2 | 5 | 47Ag | 2 | 8 | 18 | 18 | 1 | 87Fr | 2 | 8 | 18 | 32 | 18 | 8 | 1 | ||||
| 8O | 2 | 6 | 48Cd | 2 | 8 | 18 | 18 | 2 | 88Ra | 2 | 8 | 18 | 32 | 18 | 8 | 2 | ||||
| 9F | 2 | 7 | 49In | 2 | 8 | 18 | 18 | 3 | 89Ac | 2 | 8 | 18 | 32 | 18 | 9 | 2 | ||||
| 10Ne | 2 | 8 | 50Sn | 2 | 8 | 18 | 18 | 4 | 90Th | 2 | 8 | 18 | 32 | 18 | 10 | 2 | ||||
| 11Na | 2 | 8 | 1 | 51Sb | 2 | 8 | 18 | 18 | 5 | 91Pa | 2 | 8 | 18 | 32 | 20 | 9 | 2 | |||
| 12Mg | 2 | 8 | 2 | 52Te | 2 | 8 | 18 | 18 | 6 | 92U | 2 | 8 | 18 | 32 | 21 | 9 | 2 | |||
| 13Al | 2 | 8 | 3 | 53I | 2 | 8 | 18 | 18 | 7 | 93Np | 2 | 8 | 18 | 32 | 22 | 9 | 2 | |||
| 14Si | 2 | 8 | 4 | 54Xe | 2 | 8 | 18 | 18 | 8 | 94Pu | 2 | 8 | 18 | 32 | 24 | 8 | 2 | |||
| 15P | 2 | 8 | 5 | 55Cs | 2 | 8 | 18 | 18 | 8 | 1 | 95Am | 2 | 8 | 18 | 32 | 25 | 8 | 2 | ||
| 16S | 2 | 8 | 6 | 56Ba | 2 | 8 | 18 | 18 | 8 | 2 | 96Cm | 2 | 8 | 18 | 32 | 25 | 9 | 2 | ||
| 17Cl | 2 | 8 | 7 | 57La | 2 | 8 | 18 | 18 | 9 | 2 | 97Bk | 2 | 8 | 18 | 32 | 26 | 9 | 2 | ||
| 18Ar | 2 | 8 | 8 | 58Ce | 2 | 8 | 18 | 19 | 9 | 2 | 98Cf | 2 | 8 | 18 | 32 | 28 | 8 | 2 | ||
| 19K | 2 | 8 | 8 | 1 | 59Pr | 2 | 8 | 18 | 21 | 8 | 2 | 99Es | 2 | 8 | 18 | 32 | 29 | 8 | 2 | |
| 20Ca | 2 | 8 | 8 | 2 | 60Nd | 2 | 8 | 18 | 22 | 8 | 2 | 100Fm | 2 | 8 | 18 | 32 | 30 | 8 | 2 | |
| 21Sc | 2 | 8 | 9 | 2 | 61Pm | 2 | 8 | 18 | 23 | 8 | 2 | 101Md | 2 | 8 | 18 | 32 | 31 | 8 | 2 | |
| 22Ti | 2 | 8 | 10 | 2 | 62Sm | 2 | 8 | 18 | 24 | 8 | 2 | 102No | 2 | 8 | 18 | 32 | 32 | 8 | 2 | |
| 23V | 2 | 8 | 11 | 2 | 63Eu | 2 | 8 | 18 | 25 | 8 | 2 | 103Lr | 2 | 8 | 18 | 32 | 32 | 9 | 2 | |
| 24Cr | 2 | 8 | 13 | 1 | 64Gd | 2 | 8 | 18 | 25 | 9 | 2 | 104Rf | 2 | 8 | 18 | 32 | 32 | 10 | 2 | |
| 25Mn | 2 | 8 | 13 | 2 | 65Tb | 2 | 8 | 18 | 27 | 8 | 2 | 105Db | 2 | 8 | 18 | 32 | 32 | 11 | 2 | |
| 26Fe | 2 | 8 | 14 | 2 | 66Dy | 2 | 8 | 18 | 28 | 8 | 2 | 106Sg | 2 | 8 | 18 | 32 | 32 | 12 | 2 | |
| 27Co | 2 | 8 | 15 | 2 | 67Ho | 2 | 8 | 18 | 29 | 8 | 2 | 107Bh | 2 | 8 | 18 | 32 | 32 | 13 | 2 | |
| 28Ni | 2 | 8 | 16 | 2 | 68Er | 2 | 8 | 18 | 30 | 8 | 2 | 108Hs | 2 | 8 | 18 | 32 | 32 | 14 | 2 | |
| 29Cu | 2 | 8 | 18 | 1 | 69Tm | 2 | 8 | 18 | 31 | 8 | 2 | 109Mt | 2 | 8 | 18 | 32 | 32 | 15 | 2 | |
| 30Zn | 2 | 8 | 18 | 2 | 70Yb | 2 | 8 | 18 | 32 | 8 | 2 | 110Ds | 2 | 8 | 18 | 32 | 32 | 16 | 2 | |
| 31Ga | 2 | 8 | 18 | 3 | 71Lu | 2 | 8 | 18 | 32 | 9 | 2 | 111Rg | 2 | 8 | 18 | 32 | 32 | 18 | 1 | |
| 32Ge | 2 | 8 | 18 | 4 | 72Hf | 2 | 8 | 18 | 32 | 10 | 2 | 112Cn | 2 | 8 | 18 | 32 | 32 | 18 | 2 | |
| 33As | 2 | 8 | 18 | 5 | 73Ta | 2 | 8 | 18 | 32 | 11 | 2 | 113Nh | 2 | 8 | 18 | 32 | 32 | 18 | 3 | |
| 34Se | 2 | 8 | 18 | 6 | 74W | 2 | 8 | 18 | 32 | 12 | 2 | 114Fl | 2 | 8 | 18 | 32 | 32 | 18 | 4 | |
| 35Br | 2 | 8 | 18 | 7 | 75Re | 2 | 8 | 18 | 32 | 13 | 2 | 115Mc | 2 | 8 | 18 | 32 | 32 | 18 | 5 | |
| 36Kr | 2 | 8 | 18 | 8 | 76Os | 2 | 8 | 18 | 32 | 14 | 2 | 116Lv | 2 | 8 | 18 | 32 | 32 | 18 | 6 | |
| 37Rb | 2 | 8 | 18 | 8 | 1 | 77Ir | 2 | 8 | 18 | 32 | 15 | 2 | 117Ts | 2 | 8 | 18 | 32 | 32 | 18 | 7 |
| 38Sr | 2 | 8 | 18 | 8 | 2 | 78Pt | 2 | 8 | 18 | 32 | 17 | 1 | 118Og | 2 | 8 | 18 | 32 | 32 | 18 | 8 |
| 39Y | 2 | 8 | 18 | 9 | 2 | 79Au | 2 | 8 | 18 | 32 | 18 | 1 | ||||||||
| 40Zr | 2 | 8 | 18 | 10 | 2 | 80Hg | 2 | 8 | 18 | 32 | 18 | 2 |
| Легенда | |||
|---|---|---|---|
| 35Br | d-елементи | 37Rb | s-елементи |
| 118Uuo | f-елементи | 39Y | p-елементи |
Посилання
Джерела
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
