Ненасичені вуглеводні
Ненаси́чені вуглево́дні — до ненасичених вуглеводнів відносяться алкени та алкіни. Ненасиченим вуглеводням протиставляються алкани — насичені вуглеводні. Ненасиченими називаються вуглеводні, що мають хоча б один подвійний або потрійний (кратний) карбонний зв’язок.
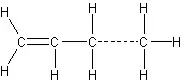
Алкени
ненасичені вуглеводні етиленового ряду, їхні назви походять від назв відповідних насичених вуглеводнів, в яких закінчення -ан замінено закінченням -ілен (або -илен). В таблиці наведені назви і будова деяких етиленових вуглеводнів.
| Назви насичених вуглеводнів | Формула | Назви ненасичених вуглеводнів | Формула |
|---|---|---|---|
| Метан | |||
| Етан | С2Н6 | Етилен | С2Н4, або СН2=СН2 |
| Пропан | С3Н8 | Пропен | С3Н6, або СН3—СН=СН2 |
| Бутан | С4Н10 | Бутен | С4Н8, або СН3—СН2—СН=СН2 |
| Пентан | С5Н12 | Пентен | С5Н10, або СН3—(СН2)2—СН=СН2 |
| Гексан | С6Н14 | Гексен | С6Н12, або СН3—(СН2)3—СН=СН2 |
| Гептан | С7Н16 | Гептен | С7Н14, або СН3—(СН2)4—СН=СН2 |
Молекула наступного члена гомологічного ряду відрізняється від молекули попереднього, як і в ряді насичених вуглеводнів, на гомологічну різницю СН2. У молекулах етиленових вуглеводнів на два атоми водню менше, ніж у молекулах відповідних насичених вуглеводнів, внаслідок наявності подвійного зв'язку. Склад етиленових вуглеводнів виражається загальною формулою СnН2n.
Нижчі етиленові вуглеводні (етилен, пропілен і бутилен) при звичайній температурі — гази, вуглеводні із складом від С5Н10 до С17Н34 — рідини, а починаючи з вуглеводню С18Н36 і вищі — тверді речовини. У воді етиленові вуглеводні, як і вуглеводні ряду метану, нерозчинні, але в спирті та інших органічних розчинниках розчиняються.
У хімічному відношенні гомологи етилену досить активні. Подібно до етилену вони легко окислюються, вступають у реакції приєднання і полімеризації. Хімічна активність етиленових вуглеводнів обумовлюється наявністю у їх молекулах подвійного зв'язку.
Вуглеводні з двома подвійними зв'язками
Крім вуглеводнів з одним подвійним зв'язком, відомі вуглеводні з двома подвійними зв'язками. їх назви походять теж від назв насичених вуглеводнів, в яких закінчення -ан замінено на закінчення -діен на відміну від закінчення -ен у етиленових вуглеводнів (ди — два). Наприклад: бутан — СН3—СН2—СН2—СН3, бутилен — СН3—СН2—СН=СН2 (один подвійний зв'язок) і бутадієн — СН2=СН—СН=СН2 (два подвійних зв'язки). Тому вуглеводні з двома подвійними зв'язками називають дієновими. Ці вуглеводні більш ненасичені, ніж етиленові. їх склад виражається загальною формулою: СnН2n-2.
Два подвійних зв'язки в молекулах дієнових вуглеводнів можуть розміщуватись по-різному. Найбільше практичне значення мають ті дієнові вуглеводні, в молекулах яких подвійні зв'язки розділені одним одинарним зв'язком. Серед таких вуглеводнів найважливіші бутадієн, або дивініл (С4Н6) і метилбутадієн, або ізопрен (С5Н8). Бутадієн (СН2=СН—СН=СН2) являє собою безбарвний газ з характерним запахом. При —4,5°С він скраплюється в безбарвну рідину. Його називають ще дивінілом, бо молекула бутадієну ніби складається з двох з'єднаних між собою радикалів етилену СН2=СН—, які називають вінілом. Ізопрен — безбарвна рідина, яка кипить при 34,1°С. Його називають ще метилбутадієном, бо він є заміщеним бутадієну.
СН2=С—СН=СН2
|
CH3
За хімічними властивостями дієнові вуглеводні дуже подібні до етиленових. Найхарактерніші для них реакції приєднання і полімеризації. Бутадієн і ізопрен широко застосовуються для одержання синтетичних каучуків.
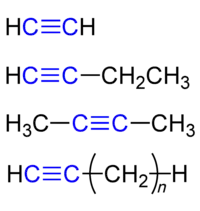
Алкіни
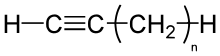
Алкі́ни, ацетиле́нові вуглево́дні, члени групи вуглеводнів із загальною формулою CnH2n-2, називаються також ацетиленами, ненасичені сполуки; характеризуються одним чи більше потрійними зв'язками між атомами вуглецю.
Легкі алкіни — гази, більш важкі — рідини або тверді речовини.
Хімічні властивості алкінів подібні до властивостей ацетилену.
Джерела
- Ф. А. Деркач «Хімія» Л. 1968
