Ацетилен
Ацетиле́н (етин) — безбарвний газ, без запаху, легший за повітря.
| Ацетилен | |
|---|---|
 Ацетилен | |
Ацетилен | |
 Ацетилен - просторова модель | |
 просторова модель твердого ацетилену | |
| Систематична назва | Ethyne[1] |
| Ідентифікатори | |
| Номер CAS | 74-86-2 |
| PubChem | 6326 |
| Номер EINECS | 200-816-9 |
| DrugBank | 15906 |
| KEGG | C01548 |
| ChEBI | 27518 |
| RTECS | AO9600000 |
| SMILES |
C#C |
| InChI |
1/C2H2/c1-2/h1-2H |
| Номер Бельштейна | 906677 |
| Номер Гмеліна | 210 |
| Властивості | |
| Молекулярна формула | C2H2 |
| Молярна маса | 26,04 г/моль |
| Зовнішній вигляд | Безбарвний газ |
| Запах | Без запаху |
| Густина | 1,097 г/л = 1.097 кг/м3 |
| Тпл | −80,8 |
| Розчинність (вода) | малорозчинний |
| Тиск насиченої пари | 44,2 атм (20 °C)[2] |
| Кислотність (pKa) | 25[3] |
| Структура | |
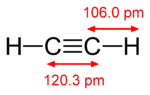
| Геометрія | Лінійна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
+226.88 кДж/моль |
| Ст. ентропія S |
201 Дж/(моль·К) |
| Небезпеки | |
| ГДК (США) | немає[2] |
| ГГС піктограми |   |
| ГГС запобіжних заходів | P202, P210, P261, P271, P304, P340, P312, P377, P381, P403, P403, P233, P405, P501 |
| NFPA 704 |
 4
1
3
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Ацетилен — при нормальних умовах — безбарвний газ, малорозчинний в воді, легший за повітря. При сильному охолодженні переходить відразу в білу кристалічну речовину, минаючи рідкий стан. При —83,6°С випаровується (сублімує), не розплавляючись. При стисненні розкладається з вибухом, зберігають в балонах, заповнених активованим вугіллям, що просочене ацетоном, в якому ацетилен розчиняється під тиском в великих кількостях. Вибухонебезпечний. C2Н2 виявлений на Урані і Нептуні.
Будова
Хімічна формула C2Н2. Два магнітні ядра є еквівалентними з точки зору симетрії: ,
де - хімічний зсув. Спінова система C2Н2 -
Спінова система ізотоп-заміщеного похідного :
Два протони й два ядра є хімічно, але не магнітно еквівалентні. Оскільки константи спін-спінової взаємодії не є рівними:
Хімічні властивості
У хімічному відношенні ацетилен активніший, ніж етилен. Висока хімічна активність ацетилену обумовлюється наявністю в його молекулі потрійного зв'язку. Для ацетилену, як і етилену, характерні реакції окиснення, приєднання і полімеризації.
Окиснення з утворенням карбонових кислот
Алкіни окиснюються з розщепленням потрійного зв'язку і утворенням карбонових кислот. У випадку ацетилену це буде мурашина кислота. Окисниками можуть бути: перманганат та дихромат калію, оксид хрому(VI), озон.
Реакція горіння
Ацетилен горить кіптявим полум'ям. Суміш ацетилену з повітрям чи з киснем вибухонебезпечна. Межі вибуховості його сумішей з повітрям складають 2,2-81; з киснем 2,3-93 об'ємних %.
Взаємодія з галогенами та галогеноводнями
Ацетилен легко знебарвлює бромну воду, приєднуючи при цьому бром за місцем розриву спочатку одного, а потім і другого зв'язку з утворенням відповідно дибромоетену С2Н2Br2, а потім тетрабромоетану С2Н2Br4:
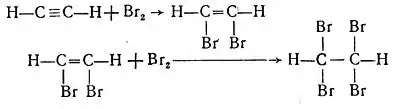
У присутності гідроксиду натрію може також вступати у реакції заміщення з бромом:
При взаємодії з хлороводнем у присутності каталізатора ацетилен утворює вінілхлорид СН2=CHCl:
![]()
Ця реакція має велике практичне значення, оскільки вінілхлорид широко використовується для одержання полімерних матеріалів.
Приєднання карбонільних сполук
При приєднанні карбонільних сполук утворюються спирти. В цій реакції, на відміну від інших реакцій приєднання, потрійний зв'язок залишається. З формальдегідом утворює пропінол, а далі — 2-бутин-1,4-діол:
При взаємодії з іншими альдегідами утворює вторинні спирти, а з кетонами — третинні:
Приєднання кислот
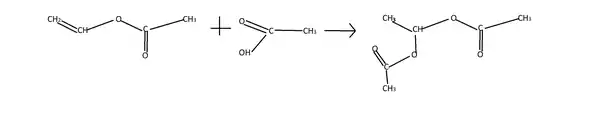
Ацетилен може приєднувати карбонові кислоти, утворюючи естери вініловго спирту. Каталізатором у цій реакції є солі ртуті(||) та міді(|):
Вінілацетат, який утворюється при взаємодії ацетилену з оцтовою кислотою, використовується для отримання полівінілацетату (ПВА) — полімеру з широким застосуванням.
Вінілові естери, що утворюються при цій реакції, здатні ще приєднувати карбонові кислоти з утворенням діестерів — ацеталів:
Гідрування
У присутності порошку нікелю як каталізатора ацетилен легко вступає і в реакцію гідрування. При цьому, як і у випадку галогенування, реакція відбувається у дві стадії. Спочатку утворюється етилен, а потім етан:
Взаємодія зі спиртами
В присутності алкоголятів взаємодіє зі спиртами, утворюючи етери:
Механізм реакції такий: спочатку алкоголят роспадається на та . Потім приєднується до молекули ацетилена, утворюючи карбоаніон, та іон металу, а від молекули спирта відщеплюється протон, який приєднується до карбоаніона. , що залишився від спирту, взаємодіє з новою молекулою ацетилену, і реакція повторюється.
При взаємодії ацетилену зі спиртами та монооксидом вуглецю утворюються естери — акрилати:
Полімеризацією метилакрилату, який утворюється у цій реакції (якщо там метанол) отримають поліметилакрилат.
Гідратація
Ацетилен вступає також у реакцію гідратації з утворенням етаналю:
Каталізатором у цій реакції є розчин сульфату меркурію у 10% сульфатній кислоті. Cпочатку іон Hg2+ переторюється на Hg+., а H2O - на H2O+. Ці іони приєднуються до потрійного зв'язку з утворенням . Потім протон відщеплюється і знову приєднується у вигляді атома гідрогену на місце іону меркурію, залишаючи каталізатор: . Далі завдяки кето-енольній таутомерії отриманий вініловий спирт перетворюється на етаналь: .
Взаємодія з металлами
Внаслідок високої електронегативності карбону в стані sp3-гібридизації атоми гідрогену в ацетилені є рухливими, тобто ацетилен є слабкою кислотою. При пропусканні ацетилена у розчини солей перехідних металлів випадає осад ацетиленидів металлів, наприклад ацетиленід срібла.
Полімеризація
У присутності CuCl в кислому середовищі може димеризуватися з утворенням вінілацетилену. При цьому утворюється побічний продукт — дивінілацетилен:
При нагріванні до 450 °С у присутності активованого вугілля циклотримеризується з утворенням бензену:

При нагріванні до 100°С циклотетрамеризується з утворенням октатетраєну (реакція проходить аналогічно тримеризації, але в ній беруть участь чотири молекули).
У присутності радикальних ініціаторів або металоорганічних каталізаторів полімеризується у полієн:
Застосування
Головною галуззю застосування ацетилену є хімічна промисловість. Ацетилен служить вихідною сировиною для синтезу таких важливих хімічних продуктів, як пластмаси, бензол, ацетатна кислота і ін. У техніці значні кількості ацетилену використовуються при автогенному зварюванні і різанні металів.
Отримання
Раніше ацетилен одержували лише з карбіду кальцію при взаємодії його з водою, переважно в апаратах з саморегулюванням реакції, що діяли за принципом апарату Кіппа:
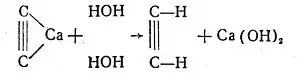
Великі кількості ацетилену добувають при термічному розкладі(піролізі) метану (природного газу):
- 2СН4 -> С2Н2 + 3Н2
Процес проводять при температурі близько 1500 °C. Щоб запобігти розкладу одержаного ацетилену на вуглець і водень, метан швидко продувають через зону високої температури. При цьому разом з ацетиленом утворюється також водень.
Його також можна отримати дегідрогалогенуванням диброметану за допомогою гідроксиду калію:
Примітки
- Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals, IUPAC Nomenclature of Organic Chemistry
- NIOSH Pocket Guide to Chemical Hazards #0008. Національний інститут охорони праці (NIOSH).
- Acetylene - Gas Encyclopedia Air Liquide. Air Liquide. Процитовано 27 вересня 2018.
Див. також
Джерела
- Хімія / Ф. А. Деркач. — Львів: Видавництво Львівського держуніверситету, 1968.
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
- Шемчук Л. М. Ацетиленові вуглеводні // Фармацевтична енциклопедія
- Алкіни, ацетилен // Отримання знань: дистанційна підтримка освіти школярів
- Ацетилен // О. І. Доридор. Хімія: шкільний курс
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.