Нітрилотриоцтова кислота
Нітрилотриоцтова кислота (англ. Nitrilotriacetic acid, скороч. NTA) — хімічна сполука, поліамінокарбонова кислота з формулою N(CH2CO2H)3. Безбарвна тверда речовина, використовується як хелатор, утворює координаційні сполуки (хелати) з такими іонами як Ca2+, Cu2+, Fe3+.[1]
| Нітрилотриоцтова кислота | |
|---|---|
 | |
| Інші назви | NTA |
| Ідентифікатори | |
| Номер CAS | 139-13-9 |
| PubChem | 8758 |
| Номер EINECS | 205-355-7 |
| DrugBank | 03040 |
| KEGG | C14695 |
| Назва MeSH | D02.241.081.018.588 |
| ChEBI | 44557 |
| RTECS | AJ0175000 |
| SMILES |
OC(=O)CN(CC(O)=O)CC(O)=O |
| InChI |
InChI=1S/C6H9NO6/c8-4(9)1-7(2-5(10)11)3-6(12)13/h1-3H2,(H,8,9)(H,10,11)(H,12,13) |
| Номер Бельштейна | 1710776 |
| Номер Гмеліна | 3726 |
| Властивості | |
| Молекулярна формула | C6H9NO6 |
| Молярна маса | 191,14 г/моль |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Виробництво
Нітрилотриоцтова кислота виробляється у промисловості у вільному вигляді, а також у вигляді натрієвої солі. Вихідними сполуками для синтезу є аміак, формальдегід, а також ціанід натрію або синильна кислота. У світі виробляється близько 100 тис. тон на рік.[2]
Нітрилотриоцтова кислота також є побічним продуктом у синтезі EDTA.[3]
Застосування
Властивості і сфера застосування NTA близькі до EDTA, іншого хелатору. На відміну від EDTA, NTA легко руйнується в живих організмах і того не загрожує довкіллю. Нітрилотриоцтова кислота використовується для пом'якшення води а також як замінник для поліфосфатів в засобах побутової хімії.[2] NTA є тетрадентатним трианіонним лігандом.[4] В аналітичній хімії вона використовується як реагент для комплексометричного титрування.
Похідні нітрилотриоцтової кислоти іммобілізовані на полімерному носії використовуються в біотехнології та біохімії для виділення та очистки білків мічених His-теґом. NTA на полімерному носії утворює координаціні зв'язки з іонами нікелю, не насичуючи при цьому його координаційну сферу. Через це білки що містять спеціально розташовані поруч залишки гістидину зв'язуватись з Ni-NTA на поверхні.[5]
- NTA комплекси
(aq)23views.png.webp) Вигляд комплексу [Ni(NTA)(H2O)2]− в трьох проекціях.
Вигляд комплексу [Ni(NTA)(H2O)2]− в трьох проекціях.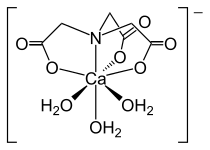 Структура комплексу [Ca(NTA)(H2O)3]−.
Структура комплексу [Ca(NTA)(H2O)3]−.
Посилання
- NITRILOTRIACETIC ACID AND ITS SALTS, International Agency for Research on Cancer (IARC)
- Charalampos Gousetis, Hans-Joachim Opgenorth (2005), «Nitrilotriacetic Acid», Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_377
- Hart, J. Roger (2005) «Ethylenediaminetetraacetic Acid and Related Chelating Agents» in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a10_095
- B. L. Barnett, V. A. Uchtman "Structural investigations of calcium-binding molecules. 4.
- qiaexpressionist