Комплексні сполуки
Ко́мплексні сполу́ки або координаці́йні сполу́ки — складні хімічні сполуки, в яких можна виділити центральний атом (комплексоутворювач) і безпосередньо зв'язані з ним молекули або йони (так звані ліганди). Центральний атом та ліганди утворюють внутрішню сферу (комплекс), а молекули або йони, які оточують [[]] відповідну зовнішню координаційну сферу. Центральним атомом можуть бути як метали змінної валентності з позитивним зарядом ядра, так і неметали. Утворення комплексних сполук широко використовується в різноманітних галузях хімічної технології (виділення, очищення, розділення платинових, рідкісноземельних та деяких інших металів).
Загальні відомості про комплексні сполуки
Хімія комплексних сполук (координаційна хімія) є однією з галузей сучасної хімії, що інтенсивно розвиваються. У зв'язку з цим, поняття «комплексні сполуки» постійно уточнюється і доповнюється.
Відповідно до класичного визначення, комплексні сполуки — це сполуки, до складу яких входять комплексні частинки, що вміщують центральний атом (комплексоутворювач) оточений лігандами.
За Франком Коттоном і Джефрі Вілкінсоном дане визначення комплексних сполук потребує деяких уточнень:
- комплексоутворювач і ліганди повинні бути стабільними при звичайних умовах;
- реакції комплексоутворення повинні протікати у звичайних хімічних умовах;
- до комплексних сполук слід віднести також продукти приєднання лігандів до молекул: SiF4 + F- = SiF2-6 і продукти взаємодії молекул за донорно-акцепторним механізмом: NH3 + BF3 = NH3BF3.
Отже, класичне визначення комплексних сполук потребує доповнень.
Комплексні сполуки — це сполуки, до складу яких входять комплексні частинки (комплекси), що вміщують центральний атом (комплексоутворювач) оточений лігандами. Утворення комплексів можна представити як результат взаємодії за донорно-акцепторним механізмом стабільних при звичайних умовах частинок: атомів, йонів або молекул.
Приведене вище визначення вказує, що, наприклад, такі частинки як CH4, SO2-4, NO-3 та інші недоцільно представляти як комплекси, оскільки частинки C+ і H-, S6+ і О2-, N5+ і О2- при звичайних умовах не існують.
Найхарактернішим комплексоутворення є саме для d-елементів.
Наявність значної кількості валентних частково заповнених орбіталей і схильність до утворення ковалентного зв'язку визначає значну кількість комплексних сполук, що утворюють d-елементи.
Основні терміни
Комплексна сполука — хімічна речовина, до складу якого входять комплексні частинки. В даний час строгого визначення поняття «комплексна частка» немає. Зазвичай використовується наступне визначення.
Комплексна частка — складна частинка, здатна до самостійного існування в кристалі або розчині, утворена з інших, більш простих частинок, також здатних до самостійного існування. Іноді комплексними частинками називають складні хімічні частинки, всі або частину зв'язків в яких утворені за донорно-акцепторним механізмом.
Комплексоутворювач — центральний атом комплексної частинки. Зазвичай комплексоутворювач — атом елемента, що утворює метал, але це може бути й атом кисню, азоту, сірки, йоду й інших елементів, що утворюють неметали. Комплексоутворювач зазвичай позитивно заряджений і в такому випадку іменується в сучасній науковій літературі металоцентром, заряд комплексоутворювача може бути також негативним або рівним нулю.
Ліганди (аденди) — атоми або ізольовані групи атомів, що розташовуються навколо комплексоутворювача. Лігандами можуть бути частинки, до утворення комплексної сполуки представляли собою молекули (H2O, CO, NH3 тощо), аніони (OH−, Cl−, PO43− тощо), а також катіон водню H+.
Внутрішня сфера комплексної сполуки — центральний атом зі зв'язаними із ним лігандами, тобто власне комплексна частка.
Зовнішня сфера комплексної сполуки — інші частинки, пов'язані з комплексною часткою йонними або міжмолекулярними зв'язками, включно з водневими.
Дентатність ліганда визначається числом координаційних місць, займаних лігандом в координаційній сфері комплексоутворювача. Розрізняють монодентатні (унідентатні) ліганди, пов'язані з центральним атомом через один зі своїх атомів, тобто одним ковалентним зв'язком, бідентатні (пов'язані з центральним атомом через два своїх атома, тобто, двома зв'язками), три-, тетрадентатні тощо.
Координаційний поліедр — уявний молекулярний багатогранник, в центрі якого розташований атом-комплексоутворювач, а у вершинах — частинки лігандів, безпосередньо пов'язані з центральним атомом.
Координаційне число (КЧ) — число хімічних зв'язків, утворених центральним атомом з лігандами. Для комплексних сполук з монодентантними лігандами КЧ дорівнює числу лігандів, а в разі полідентантних лігандів — числу таких лігандів, помноженому на дентатність.
Типи комплексних сполук
Існує кілька типів комплексних сполук, в основу яких покладені різні принципи.
За зарядом комплексу
1) Катіонні комплекси утворені в результаті координації навколо позитивного йона нейтральних молекул (H2O, NH3 тощо).
[Zn(NH3)4]Cl2 — хлорид тетраамінцинку(II)
[Co(NH3)6]Cl2 — хлорид гексаамінкобальту(II)
2) Аніонні комплекси – комплекси, в ролі комплексоутворювача яких виступає атом з позитивним ступенем окиснення, а лігандами є прості або складні аніони.
K2[BeF4] — тетрафтороберилат(II) калію
Li[AlH4] — тетрагідридоалюмінат(III) літію
K3[Fe(CN)6] — гексаціаноферрат(III) калію
3) Нейтральні комплекси утворюються при координації молекул навколо нейтрального атома, а також при одночасній координації навколо позитивного йона — комплексоутворювача негативних йонів і молекул.
[Ni(CO)4] — тетракарбонілнікель
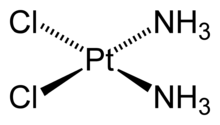
[Pt(NH3)2Cl2] — дихлородіамінплатина(II)
За кількістю місць, займаних лігандами в координаційній сфері
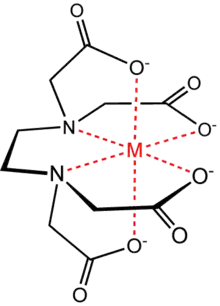
1) Монодентатні ліганди. Такі ліганди бувають нейтральними (молекули Н2О, NH3, CO, NO тощо) і зарядженими (йони CN−, F−, Cl−, OH−, SCN− тощо).
2) Бідентатні ліганди. Прикладами служать ліганди: йон гліцину H2N−CH2−COO−, оксалатний йон −O−CO−CO−O−, карбонат-йон СО32−, сульфат-йон SO42−, тіосульфат-йон S2O32−.
3) Полідентатні ліганді. Наприклад, комплексони — органічні ліганди, що містять в своєму складі кілька груп −С≡N або −COOH (етилендіамінтетраоцтова кислота — ЕДТА). Циклічні комплекси, утворені деякими полідентатними лігандами, відносять до хелатних (гемоглобін та ін.).
За природою ліганда
1) Амміакати — сполуки, в яких лігандами служать молекули аміаку, наприклад: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 та ін.
2) Аквакомплекси — в яких лігандом виступає вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 та ін.
3) Карбоніли — комплексні сполуки, в яких лігандами є молекули оксиду вуглецю (II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплекси — комплекси, в яких лігандами є кислотні залишки. До них належать комплексні солі: K2[PtCl4], комплексні кислоти: H2[CoCl4], H2[SiF6].
5) Гідроксокомплекси — комплексні сполуки, в яких як ліганди виступають гідроксид-йони: Na2[Zn(OH)4], Na2[Sn(OH)6] та ін.
Геометрія комплексних сполук
Розташування атомів навколо металічного центра (зокрема металів d-блоку) в координаційних частинках. Воно залежить від природи атома металу та його координаційного числа. Певним координаційним числам може відповідати більше одного розташування донорних атомів (менш загальні зазначені в дужках). Координаційному числу 2 відповідає лінійне розташування атомів біля металічного центра, 3 — тригональне планарне (тригональне пірамідальне), 4 — тетраедральне, квадратно планарне, 5 — тригональне біпірамідальне, пірамідальне з квадратом в основі, 6 — октаедральне (тригональне призматичне), 7 — пентагональноьбіпірамідальне (одновершинно тригонально призматичне, одновершинно октаедральне), 8 — додекаедральне, квадратно антипризматичне, гексагонально пірамідальне (кубічне, двовершинне тригональне призматичне), 9 — тривер-шиннетригонально призматичне. Така регулярна геометрія незавжди витримується через наявність, наприклад стеричних ефектів.
Координаційні числа d-елементів
Найхарактернішими координаційними числами d-елементів є 4 і 6 (наприклад: [Pt(NH3)4]Cl2, К2[Ni(CN)4], К4[Fe(CN)6], Na3[Co(NO2)6]). Менш характерним є координаційне число 2, яке, як правило, мають d-елементи у ступені окиснення +1, наприклад: [Ag(NH3)2]Cl, Na[Au(CN)2]. Координаційні числа вищі за 6 є мало характерними і зустрічаються лише для деяких d-елементів другого і третього рядів (MI3[ZrF7], MI4[ZrF8]). Величина координаційного числа визначається електронною будовою, а також розмірами комплексоутворювача і лігандів.
Стабільність комплексів d-елементів
Серед монодентантних лігандів найбільш стабільні комплекси з d-елементами утворюють ціанід-йон, аміак, галогенід-йони і деякі інші. Утворення ціанідних комплексів є характерним для елементів підгрупи Купруму, підгрупи Цинку і d-елементів VIII групи. Вказані вище елементи (за винятком Феруму) утворюють також досить стабільні аміачні комплекси. Всі d-елементи утворюють більш-менш стабільні галогенідні комплекси.
Найменш характерним комплексоутворення є для елементів підгрупи Скандію і Титану. Для даних елементів характерним є утворення фторидних комплексів складу MI3[ЭIIIF6] і MI4[ЭIVF6].
Також для визначення стабільності металорганічних комплексів користуються емпіричним правилом 18 електронів: стабільним буде той комплекс, на зовнішній валентній орбіталі якого є 18, як його власних електронів, так і електронів лігандів.
Багатоядерний комплекс
Багатоядерний комплекс (англ. polynuclear complex) — комплексна сполука, що має два або більше центральних атомів, ліганди яких утворюють координаційні сфери, що сполучаються за рахунок місткових атомів чи груп. Центральні атоми металів можуть також сполучатись між собою, в цьому випадку порядок зв'язків між n атомами металів розраховується за правилом (n×18 — Qe)/2, де Qe — загальна кількість електронів у комплексі.
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0