Перегріта рідина
Перегрі́та рідина́ (англ. superheated liquid) — рідина, що нагріта до температури, вищої за температуру кипіння[1]. Перегріта рідина є прикладом метастабільного стану, який за певних умов у низці енергетичних і технологічних режимів спричиняє такі специфічні динамічні явища, як вибухоподібне закипання за рахунок накопиченого тепла, нестійкість поверхні розділення рідина-пара, формування фронту фазового переходу.
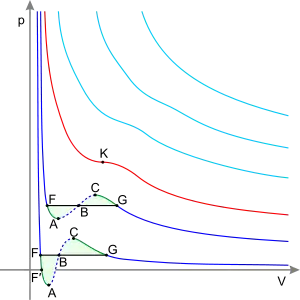
Лінії:
Сині — ізотерми за температури нижчої від критичної. Зелені ділянки на них — метастабільні стани.
Червона — критична ізотерма.
Блакитні — надкритичні ізотерми.
Точки:
Точка F — точка кипіння.
Точка K — критична точка.
Точка G — точка роси.
Ділянки:
Ділянка, що лежить лівіше від точки F — нормальна рідина.
Пряма FG — рівновага рідкої і газоподібної фази.
Ділянка FA — перегріта рідина.
Ділянка F′A — розтягнена рідина (p<0)
Ділянка AC — аналітичне продовження ізотерми, фізично неможливий стан.
Ділянка CG — пересичена (переохолоджена) пара.
Ділянка, що лежить правіше від точки G — нормальний газ (перегріта пара).
Примітка: Площі фігур FAB і GCB однакові.
Загальні поняття
Величина перегріву залежить від низки фізико-хімічних властивостей як самої рідини, так і граничних твердих поверхонь. Ретельно очищені рідини позбавлені розчинених газів (повітря), можна при дотриманні особливих запобіжних засобів перегріти на десятки градусів без закипання. Коли така перегріта рідина врешті-решт закипає, то процес кипіння протікає вельми бурхливо, нагадуючи вибух. Закипання перегрітої рідини супроводжується розбризкуванням рідини, гідравлічними ударами й інколи навіть руйнуванням посудини. Теплота перегріву витрачається на паротворення, тому рідина швидко охолоджується до температури насиченої пари, з якою вона перебуває у рівновазі. Можливість значного перегрівання чистої рідини без кипіння пояснюється утрудненістю виникнення початкових маленьких бульбашок (зародків), їх утворенню перешкоджає значне взаємне притягання молекул рідини. По іншому відбувається, коли рідина містить розчинені гази й різні найдрібніші завішені тверді часточки. В цьому випадку вже незначне перегрівання (на десяті долі градуса) викликає стійке і спокійне кипіння, оскільки початковими зародками парової фази служать газові бульбашки та тверді частки. Основні центри пароутворення мають місце в точках поверхні, до якої підводиться тепло і є найдрібніші пори з адсорбованим газом, а також різні неоднорідності, включення і нальоти, які знижують молекулярне зчеплення рідини з поверхнею.
Умови існування перегрітої рідини
Існування перегрітих (метастабільних) станів пов'язане із утрудненістю початкової стадії фазового переходу першого роду. Преривчастий характер переходу (, ; тут — питома ентропія, — питомий об'єм) виключає можливість перетворення одночасно у всій масі речовини у стані, близькому до фазової рівноваги. Фазовий перехід починається в окремих «точках» однорідної системи, ці точки повинні задовольняти умову ( — радіус зародка, — радіус критичного зародка) — тоді ріст нової фази супроводжується зменшенням термодинамічного потенціалу.
Характеристикою потенціального бар'єру, який слід подолати зародку для досягнення критичного розміру, є робота з утворення критичного зародка:
де
- — об'єм критичної бульбашки;
- — радіус критичної бульбашки;
- — тиск пари на лінії насичення (при даній );
- — тиск у рідині;
- — питомий об'єм рідини;
- — питомий об'єм пари.
також можна записати через рівноважні властивості:
де — коефіцієнт поверхневого натягу.
Приклади
Якщо з рідини видалити розчинене повітря (багатократним кип'ятінням) і можливі центри пароутворення (пилинки, іони тощо), то можна нагріти рідину до температури, дещо вищої від температури кипіння. Такий стан називається перегрітою рідиною. Стан перегрітої рідини також можна одержати і при зниженні зовнішнього тиску до рівня нижчого за тиск насиченої пари рідини за даної температури.
Аргон за атмосферного тиску:
- tнасичення = −186 °C
- tдосяжного перегрівання = −142 °C.
Звідси видно, що досяжне перегрівання становить 44 градуси.
Вода дозволяє стійке перегрівання до 200 °C. Нагріта до 300 °C вода може існувати у рідкому стані за атмосферного тиску протягом часу порядку декількох мікросекунд.
Див. також
Примітки
- Яворський Б. М., Детлаф А. А., Лебедев А. К. Довідник з фізики для інженерів та студентів вищих навчальних закладів / Переклад з 8-го переробл. і випр. вид. Т.: Навчальна книга — Богдан, 2007. — 1040 с. — C.277-278. — ISBN 966-692-818-3
Джерела
- Ривкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара. Справочник. — 2-е изд., перераб., и доп. — М.: Энергоатомиздат, 1984. — 80 с.
- Скрипов В. П. Метастабильная жидкость. М.: Наука, 1972. — 312 с.
- Теплофизические свойства жидкостей в метастабильном состоянии / В. П. Скрипов, Е. Н. Синицын, П. А. Павлов и др. М.: Атомиздат, 1980. — 208 с.
- Павлов П. А. Динамика вскипания сильно перегретых жидкостей. Свердловск, 1988. — 248 с.
- Глосарій термінів з хімії // Й.Опейда, О.Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л.М.Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. — ISBN 978-966-335-206-0
Посилання
- Гервидс В. И. Перегретая жидкость на YouTube. НДЯУ МІФІ (10.03.2011). — Фізичні демонстрації.
- В. Е. Виноградов (2006). Исследование вскипания перегретых и растянутых жидкостей (Автореферат диссертации на соискание учёной степени доктора физико-математических наук). Институт теплофизики Уральского отделения РАН. с. 43. Архів оригіналу за 22 серпня 2011. Процитовано 28 липня 2011.