Ізотермічний процес
Ізотермі́чний проце́с — фізичний (термодинамічний) процес, що відбувається у фізичній (термодинамічній) системі при сталій температурі[1].
| Частина серії статей на тему: | ||||||||
| Термодинаміка | ||||||||
|---|---|---|---|---|---|---|---|---|
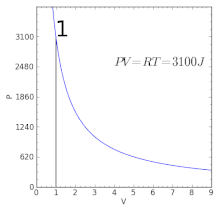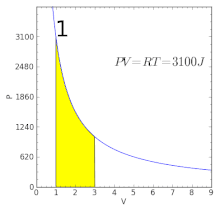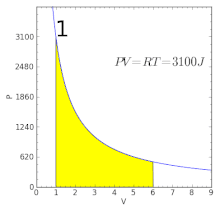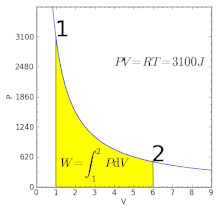 Графік ізотермічного процесу | ||||||||
|
Розділи |
||||||||
|
||||||||
|
Властивості
|
||||||||
|
Властивості матерії
|
||||||||
|
Рівняння
|
||||||||
|
Історія
|
||||||||
|
| ||||||||
Ізотермічний процес відбувається достатньо повільно для того, щоб температура підтримувалася сталою завдяки теплообміну із середовищем. При ізотермічному стисненні тіло віддає тепло в середовище, при ізотермічному розширенні — вбирає тепло із середовища. Прикладами ізотермічного процесу є кипіння рідини або плавлення твердого тіла при сталому тиску.
Теорія ізотермічного процесу для ідеального газу
Згідно з рівнянням стану ідеального газу (або рівняння Клайпейрона-Менделєєва), характеристики ідеального газу задовільняють рівність
- ,
де p — тиск, V — об'єм, m — маса, T — температура газу відповідно, μ — молярна маса газу, R — газова стала.
Газ сталої маси може перебувати в різних станах з різними параметрами:
Оскільки праві частини обох виразів однакові, то, порівнюючи їх ліві частини, отримаємо рівняння, справедливе для газу незмінної маси:
або
Останнє рівняння називають рівнянням Клапейрона (об'єднаним газовим законом).
Процеси, які відбуваються за незмінного значення одного з параметрів ідеального газу сталої маси m і молярної маси μ називають ізопроцесами. Оскільки жоден із параметрів газу не може бути строго фіксованим, то ізопроцес — це ідеалізована модель стану ідеального газу. Ізотермічним процесом називається процес, в якому маса газу, молярна маса газу та його температура є константами.
Якщо до ізотермічного процесу застосувати рівняння Клапейрона, то з урахуванням сталості температури воно набуде вигляду
або
тобто, для деякої маси газу добуток тиску газу на об'єм за незмінної температури є сталою величиною. Цей закон (закон Бойля — Маріотта) справедливий для будь-яких газів, які можна вважати ідеальними, а також для їхніх сумішей.
Графічно залежність тиску газу від об'єму при умові незмінності температури можна зобразити у вигляді кривої — ізотерми. Прикладами ізотермічного процесу є процес стискання повітря компресором, або розширення під поршнем насоса газу внаслідок відкачування його з посудини.
Примітки
- Ізотермні процеси // Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.
Джерела
- Яворський Б. М. Довідник з фізики: для інженерів та студентів вищих навч. закладів / Б. М. Яворський, А. А. Детлаф, А. К. Лебедєв. — Т. : Навчальна книга-Богдан, 2005. — 1034 с. — ISBN 966-692-818-3.
- Теплотехніка: підручник для студ. вищих техн. навч. закл / Б. Х. Драганов [та ін.]; За ред. Б. Х. Драганова. — К. : ІНКОС, 2005. — 504 с. — ISBN 966-8347-23-4.
- Буляндра О. Ф. Технічна термодинаміка: Підручн. для студентів енерг. спец. вищ. навч. закладів. — К. : Техніка, 2001. — 320 с. — ISBN 966-575-103-4.
