Реальний газ
Реа́льний газ (рос. реальный газ; англ. real gas, нім. reales Gas n, Realgas n) — газ, для якого термічне рівняння стану є відмінним від рівняння стану ідеального газу (Клапейрона-Менделєєва).
| Частина серії статей на тему: | ||||||||
| Термодинаміка | ||||||||
|---|---|---|---|---|---|---|---|---|
 Ізотерми | ||||||||
|
Розділи |
||||||||
|
||||||||
|
Властивості
|
||||||||
|
Властивості матерії
|
||||||||
|
Рівняння
|
||||||||
|
Історія
|
||||||||
|
| ||||||||
Для обчислення параметрів такого газу треба враховувати як потенціальну, так і кінетичну енергію його молекул. На формі залежностей між його параметрами відбивається те, що молекули його взаємодіють між собою та займають певний об'єм.
Модель реального газу
Стан реального газу часто при вирішенні задач технічного характеру описують узагальненим рівнянням Клапейрона-Менделєєва (технічним рівнянням стану реального газу):
де p — тиск;
- T — температура;
- Zr = Zr (p, T) — коефіцієнт стисливості газу;
- R — універсальна газова стала;
- n — кількість газу в молях, (m — маса газу; μ — молярна маса газу).
Для ідеального газу за будь-яких умов Z = 1, при якому записане рівняння перетворюється у рівняння стану ідеального газу. Для реальних газів Z може істотно відрізнятися від одиниці за певних умов, і завжди в сильно розрідженому газі (р → 0 і ρ → 0) в тому числі і для реальних газів Z → 0.
Одна з класичних моделей опису реального газу — рівняння Ван дер Ваальса:
- ,
де коефіцієнти а і b називають сталими Ван дер Ваальса, які залежать від хімічної природи речовини, температури і тиску.
Рівняння Ван дер Ваальса є наближеним рівнянням стану реального газу, причому ступінь його наближення різний для різних газів. Записана велика кількість емпіричних і напівемпіричних рівнянь стану реальних газів (рівняння: Бертло[1], Клаузіуса — Клапейрона, Дітерічі[2], Редліха — Квонга[3] тощо). За рахунок збільшення числа констант у цих рівняннях можна досягти кращого узгодження з практикою, порівняно з рівнянням Ван дер Ваальса. Проте рівняння Ван дер Ваальса завдяки своїй простоті та фізичному змісту сталих a і b, що входять до нього, є найпоширенішим для аналізу якісної поведінки реальних газів.
Фізика реального газу
Міжмолекулярна взаємодія
- Фазові перетворення
Щоб докладніше встановити умови. коли газ може перетворитися в рідину й навпаки, простих спостережень за випаровуванням або кипінням рідини не досить. Треба уважно простежити за зміною тиску і об'єму реального газу при різних температурах.
Ізотермічне стиснення
Повільно стискуватимемо газ, наприклад вуглекислий, під поршнем. Стискуючи його, ми виконуємо над ним роботу, внаслідок чого внутрішня енергія збільшуватиметься. Коли ми хочемо, щоб процес відбувався при сталій температурі, треба забезпечити добрий теплообмін між циліндром і навколишнім середовищем. Для цього можна поставити циліндр у велику посудину з рідиною при сталій температурі і стискувати газ дуже повільно, щоб теплота встигала переходити від газу до навколишніх тіл.
Виконуючи цей дослід, можна помітити, що спочатку при великому об'ємі тиск із зменшенням об'єму збільшується згідно із законом Бойля—Маріотта (див. мал. «Ізотерми»). Нарешті, починаючи з якогось значення, тиск не змінюватиметься, незважаючи на зменшення об'єму. Якщо зазирнути при цьому в циліндр крізь спеціальне оглядове віконце, то можна побачити па стінках циліндра і поршня прозорі крапельки. Це означає, що газ почав конденсуватися, тобто переходити в рідкий стан.
Продовжуючи стискувати вміст циліндра, ми збільшуватимемо масу рідини під поршнем і, отже, зменшуватимемо масу газу. Тиск, який показує манометр, залишатиметься сталим доти, поки весь простір під поршнем не заповнить рідина. Рідини мало стисливі. Тому далі, навіть при незначному зменшенні об'єму, тиск швидко зростатиме.
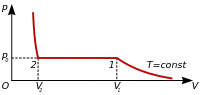
Оскільки весь процес відбувається при сталій температурі Т, криву, що зображує залежність тиску р від об'єму V, називають ізотермою. При об'ємі V1 починається конденсація газу, а при об'ємі V2 вона закінчується. Якщо V > V1 то речовина буде в газоподібному стані, а при V < V2 — в рідкому.
Досліди показують, що такий самий вигляд мають ізотерми і всіх інших газів, якщо їх температура не дуже висока.
Найістотнішою в цьому процесі є сталість тиску газу при зміні його об'єму від V1 до V2, коли газ перетворюється в рідину. Кожній точці прямолінійної частини ізотерми 1—2 відповідає рівновага між газоподібним і рідким станами речовини. Це означає, що при певних Т і V кількість рідини і газу над нею лишається незмінною. Рівновага має динамічний характер: кількість молекул, які вилітають з рідини, в середньому дорівнює кількості молекул, які переходять з газу в рідину за той самий час. Сталий тиск p0, коли рідина буде в рівновазі з своїм газом, називають тиском насиченої пари, а сам газ при цьому, як ми вже говорили, називають насиченою парою. Незалежність p0 від об'єму зумовлено тим, що зі зменшенням об'єму пари дедалі більша частина її переходить у рідкий стан. А маса рідини займає менший об'єм, ніж така сама маса газу. При стискуванні пари над рідиною рівновага порушується. Густина пари спочатку трохи зростає, і більше число молекул переходить з газу в рідину, ніж з рідини в газ. Це триватиме доти, поки відновиться рівновага, а густина і разом з нею тиск набудуть попередніх значень.
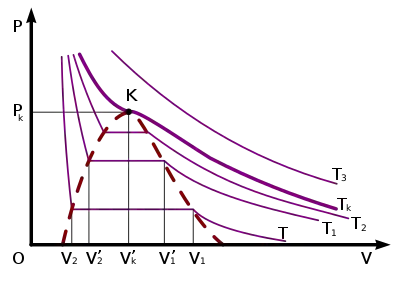
Досі ми розглядали тільки одну певну ізотерму реального газу. Тепер ознайомимось із змінами, які відбуватимуться з вуглекислим газом при вищій (але також сталій) температурі T1. Нова ізотерма, як і попередня, досить точно збігається з ізотермою ідеального газу при великих об'ємах. Починаючи з якогось об'єму V'1 < V1 вона також стає горизонтальною (див. мал. «Ізотерма»). Нарешті при об'ємі V'2 > V2 ізотерма круто підіймається вгору. Це означає, що при об'ємі V'2 рідина заповнила весь циліндр.
Якщо температура вища за температуру позначену Tк, то газ не зріджується при як завгодно великому тиску. Такими газами при звичайних температурах є, наприклад, гази повітря — азот і кисень. Див. Критична температура.
Див. також
Примітки
- D. Berthelot in Travaux et Mémoires du Bureau international des Poids et Mesures — Tome XIII (Paris: Gauthier-Villars, 1907)
- C. Dieterici Ann. Phys. Chem. Wiedemanns Ann. 69, 685 (1899).
- Redlich O., Kwong J. N. S. On the Thermodynamics of Solutions. V. An Equation of State. Fugacities of Gaseous Solutions[недоступне посилання з липня 2019] // Chemical Reviews. — 1949. — Т. 44. — № 1. — С. 233—244
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Буховцев Б. Б., Климонтович Ю. Л., Мякишев Г. Я. Фізика. Навчальний посібник для 9 класу середньої школи. К., «Радянська школа», 1972.
- Бойко В. С., Бойко Р. В. Тлумачно-термінологічний словник-довідник з нафти і газу. Тт. 1-2, 2004—2006 рр. 560 + 800 с.