Плавлення
Пла́влення (топлення) — перехід тіла з твердого стану в рідкий. Зворотний процес — тверднення (кристалізація). Плавлення відбувається з поглинанням теплоти і є фазовим переходом першого роду.
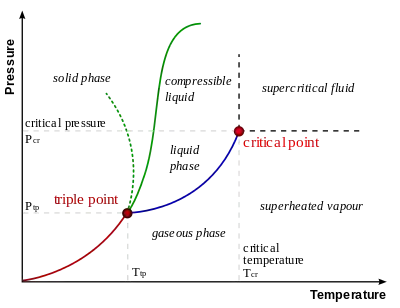

Зміна стану речовин (зокрема таких, що мають кристалічну будову) з твердого на рідкий. Рідкий кристал плавиться, коли тривимірна періодична структура твердої фази руйнується і переходить у рідинно-кристалічну фазу, в якій молекули зберігають певний орієнтаційний порядок, але вже нема далекосяжного трансляційного порядку. Це фазовий перехід першого роду. Процес плавлення є таким самим як і топлення, але термін плавлення звичайно застосовується до таких речовин як метали, які стають рідинами при високих температурах, а також до кристалічних твердих тіл, де спостерігається чітка температура фазового переходу. Цей термін також вживається для процесів нагрівання сумішей з метою отримати єдиний рідкий розчин, як при утворенні сплавів. При нормальному тиску, найбільшою температурою плавлення серед металів має вольфрам (3422 °C), а серед складних речовин — карбід гафнію HfC (3890 °C). Можна вважати, що найнижчу температуру плавлення має гелій: при нормальному тиску він залишається рідким при скільки завгодно низьких температурах.
Багато речовин при нормальному тиску не мають рідкої фази. При нагріванні шляхом сублімації вони відразу переходять у газуватий стан.
Плавлення складних сполук
У сплавів, як правило, немає певної температури плавлення; процес їх плавлення відбувається в кінцевому діапазоні температур. На діаграмах стану «температура — відносна концентрація» є кінцева область співіснування рідкого і твердого стану, обмежена кривими ліквидуса і солідуса. Аналогічна ситуація має місце і у разі багатьох твердих розчинів.
Фіксованої температури плавлення немає також у аморфних тіл; вони переходять у рідкий стан поступово, м'якшачись при рості температури.
Кінетика плавлення
Пояснимо спочатку, чому при деякій температурі тіло розриває частину міжатомних зв'язків і з впорядкованого стану (кристал) переходить у неврегульований (рідина).
Як відомо з термодинаміки, при фіксованій температурі тіло прагне мінімізувати вільну енергію F = E — TS. При низьких температурах другий доданок (добуток температури і ентропії) неістотній, і в результаті все зводиться до мінімізації звичайної енергії E.
Стан з мінімальною енергією — це кристалічне тверде тіло. При підвищенні температури, другий доданок стає дедалі важливішим, і при деякій температурі виявляється вигідніше розірвати деякі зв'язки. При цьому звичайна енергія E дещо підвищиться, але при цьому сильно зросте і ентропія, що в результаті приведе до пониження вільної енергії.
Динаміка плавлення
В динаміці, плавлення відбувається таким чином. При підвищенні температури тіла росте амплітуда теплових коливань його молекул, і вряди-годи виникають дефекти ґраток. Кожний такий дефект вимагає певної кількості енергії, бо він супроводиться розривом деяких міжатомних зв'язків. Стадія народження й накопичення дефектів зветься стадією передтоплення. Крім того, на цій стадії, як правило, виникає квазі-рідкий шар на поверхні тіла. За певної температури концентрація дефектів стає така велика, що призводить до втрати орієнтаційного порядку в зразку.
Плавлення у двовимірних системах
В двовимірних або квазі-двовимірних системах кристал є хисткішим об'єктом, ніж в тривимірному випадку, а саме у двовимірного кристала немає дальнього позиційного порядку. (Для порівняння: у одновимірному випадку кристал при скінченній температурі взагалі не може бути стабільним) Як з'ясувалося, це призводить до того, що плавлення двовимірного кристала відбувається в два етапи. Спочатку кристал переходить в так звану гексатичну фазу, в якій втрачається ближній позиційний порядок, але зберігається орієнтаційний, а потім відбувається втрата і орієнтаційного порядку і тіло стає рідким.
Джерела
- Основи металургійного виробництва металів і сплавів. — К.: Вища шк., 2006. — 503с.;
- Фізико-хімічні та металургійні основи виробництва металів. — К.: ІЗМН, 1996. — 392с.;
- Безкоксова металургія заліза. — Дніпропетровськ: РВА «Дніпро — ВАЛ», 2002. — 338с.;
- Конвертерне виробництво сталі (теорія, технологія, якість сталі, конструкція агрегатів, рециркуляція матеріалів і екологія). — Дніпропетровськ: РВА «Дніпро — ВАЛ», 2004. — 454с.;
- Проектування і обладнання електросталеплавильних і феросплавних цехів. — Дніпропетровськ: Системні технології, 2004. — 692с.;
- Автоматичні системи керування процесами спеціальної електрометалургії. — К.: Техніка, 2002. — 211с.

