Полігістидиновий тег
Полігістидиновий тег — амінокислотний мотив у білках, складається як мінімум із шести розташованих поруч залишків гістидину (His). Інші назви — гексагістидин-тег, 6xHis-тег, His6 тег, а також комерційна назва His-tag (зареєстрована EMD Biosciences). Полігістидиновий тег вводиться у білки методами генної інженерії; він може бути розташований на N- або C-кінці поліпептиду.
В молекулярній біології та біотехнології полігістидиновий тег використовують як мітку для афінної очистки рекомбінантних білків із середовища в якому вони експресуються. Він також дозволяє детектувати білки в живих клітинах за допомогою флуоресцентної мікроскопії.
Історія та правовий статус
Цей амінокислотний мотив був винайдений фармакологічною та біотехнологічною компанією Roche.[1] На основі цього тегу були розроблені комерційно-доступні засоби для швидкого виділення та очищення рекомбінантних білків; комерційні «кіти» поставляються такими компаніями як Qiagen, Sigma, Thermo Scientific, GE Healthcare, Macherey-Nagel, Clontech, Bio-Rad, та іншими. Використання тегу в академічних та некомерційних дослідженнях необмежене; в той же час, компанії, що використовують цю технологію, при виробництві комерційних продуктів мають сплачувати роялті Roche. Термін дії оригінального патенту закінчився 11 лютого 2003, і тому наразі є суспільним надбанням; сплата роялті обґрунтовується новими та більш вузькими патентами. Відповідні амінокислотні послідовності доступні для комерційного використання; наприклад, оптимізований поліпептид MK(HQ)6 може бути використаний для інтенсивної експресії в E. coli з можливістю видалення тегу з протеїну після очистки. Загальне число залишків гістидину може варіюватися. Тег може бути поєднаний із відповідними лінкерними амінокислотними послідовностями які спрощують видалення тегу з цільового білка за допомогою ендопептидаз. Використання додаткових послідовностей можна уникнути якщо полігістидиновий тег розташований на N-кінці полігістидину; в цьому разі тег може бути видалений безпосередньо за допомогою екзопептидаз.
Застосування
Виділення та очистка білків
Полігістидиновий тег дуже часто використовується для мічення та наступної очистки рекомбінантних білків, що експресуються в Escherichia coli[2] та в інших прокаріотичних системах експресії. Бактеріальні клітини, що містять білок, збираються за допомогою центрифугування та внутрішньоклітинні білки (в тому числі цільовий білок мічений тегом) переводяться в розчин після лізису (руйнації) бактеріальних клітин. Отриманий розчин багатьох білків інкубується (настоюється) у присутності полімерного носія, що містить двовалентні іони нікелю або кобальту. Полімерним носієм найчастіше є сефароза або агароза модифікована специфічними хелаторами, такими як імінодиоцтова кислота (Ni-IDA) та нітрилотриоцтова кислота (Ni-NTA) для нікелю та карбоксіметиласпартат (Co-CMA) для кобальту. Полігістидиновий тег зв'язується з цими хелаторами з мікромолярною афінністю, тоді як білки, що не містять тегу, залишаються в розчині й можуть бути відділенні промиванням колонки фосфатним буфером. Після цього рекомбінантний білок може бути «знятий» з полімерного носія за допомогою буферу, що містить 150—300 мМ імідазолу. Кількість та якість отриманого білка може бути визначена за допомогою SDS-PAGE та Вестерн-блоту.
Афінна очистка білків за допомогою полігістидинового тегу дає відносно чисті білки після експресії в прокаріотичних клітинах. Залежно від області застосування, очистка білків після експресії в еукаріотах можлива з використанням тандемної афінної очистки,[3] коли два теги використовуються для отримання білка більш високої чистоти.
Полігістидиновий тег є гарним методом очистки білків за денатуруючих умов, тому що з'вязування білка з хелатором на полімері не залежить від присутності денатуруючих агентів у середовищі.
Введення тегу
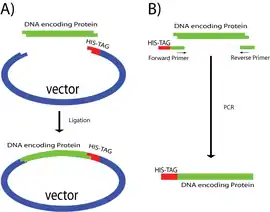
Найбільш поширеною версією полігістидинового тегу є така, що містить шість послідовних залишків гістидину (6xHis тег), які додаються до білку на N-кінець перед залишком метіоніну або на С-кінець одразу перед стоп-кодоном. Вибір способу мічення (N/C-кінець) залежить головним чином від властивостей білку та метода видалення тегу після експресії. Мічення по окремому кінцю неможливе, якщо він глибоко занурений в протеїнову глобулу, або якщо він виконує певну функцію. Більшість екзопептидаз можуть видалити полігістидиновий тег тільки якщо він розташований на N-кінці.
Є два загальні методи введення тегу в поліпептидну структуру білку. Найбільш простим методом є вставка гену що кодує білок в плазміду або інший вектор що вже містить послідовність кодуючу His-tag; таким чином, після вставки гену в вектор тег одразу попаде в протеїн-кодуючу рамку зчитування і бути приєднаний до протеїну під час експресії. Іншим загальним методом є ампліфікація гену що кодує цільовий білок за допомогою полімеразної ланцюгової реакції (ПЛР) у присутності спеціально створених праймерів; один з пари праймерів має містити декілька раз повторений гістидиновий кодон (CAT або CAC) впритул до старт- або стоп-кодонів, на додачу до власне послідовності праймера комплементарної до кінцевих нуклеотидних основ гену.
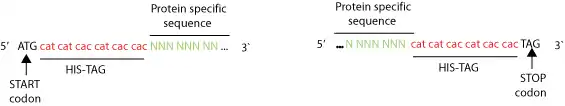
Приклад праймерів створених для введення гексагістидинового тегу за допомогою ПЛР. Вісімнадцять нуклеотидів, що кодують шість гістидинів, вставлені безпосередньо після СТАРТ-кодону або безпосередньо перед СТОП-кодоном. Як мінімум 16 нуклеотидів праймеру мають бути комплементарними до термінальних фрагментів гену, що кодує потрібний білок. Завдяки вставці шести гістидинів білок стає важчим приблизно на 1 кДа. Зазвичай, на додачу до гексагістидинового тегу, мінімальний лінкер, такий як gly-gly-gly або gly-ser-gly, вставляється між ним та протеїном; це мінімізує вплив тегу на властивості цільового білку.
Детекція
Полігістидиновий тег може бути використаний для ідентифікації міченого білку (вестерн-блот, флуоресцентна мікроскопія, тощо) за допомогою His6-специфічних антитіл.
Посилання
- Hochuli, E.; Bannwarth, W.; Döbeli, H.; Gentz, R.; Stüber, D. (1988). Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nature Biotechnology 6 (11). с. 1321–1325. doi:10.1038/nbt1188-1321.
- Hengen, P (1995). Purification of His-Tag fusion proteins from Escherichia coli. Trends in Biochemical Sciences 20 (7). с. 285–6. PMID 7667882. doi:10.1016/S0968-0004(00)89045-3.
- Gavin, AC; Bösche, M; Krause, R; Grandi, P; Marzioch, M; Bauer, A; Schultz, J; Rick, JM та ін. (2002). Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature 415 (6868). с. 141–7. PMID 11805826. doi:10.1038/415141a.