Тіїран
Тііран, відоміший, як етиленсульфід — циклічна хімічна сполука із формулою C2H4S. Це найменший сульфурвмісний гетероцикл. Як і багато інших сульфовмісних органічних речовин, ця речовина також смердить. Тіїран також постійно використовується для опису будь-якої похідної етилен сульфіду.
| Тіїран | |
|---|---|
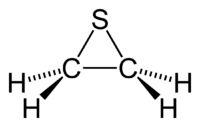 Структурна формула Тіірану | |
 Скелетна формула тіірану |
 Просторова модель тіірану |
| Назва за IUPAC | Thiirane |
| Інші назви | Етилен сульфід |
| Ідентифікатори | |
| Номер CAS | 420-12-2 |
| Номер EINECS | 206-993-9 |
| KEGG | C19419 |
| ChEBI | 30977 |
| RTECS | KX3500000 |
| SMILES |
C1CS1 |
| InChI |
InChI=1S/C2H4S/c1-2-3-1/h1-2H2 |
| Номер Бельштейна | 102379 |
| Номер Гмеліна | 1278 |
| Властивості | |
| Молекулярна формула | C2H4S |
| Молярна маса | 60,12 гр моль?1 |
| Зовнішній вигляд | рідина, зазвичай блідо-жовта |
| Густина | 1,01 гр см?3, рідина |
| Ткип | 54,0–54,5 °C |
| Розчинність (вода) | низька |
| Структура | |
| Геометрія | C2v симетрія |
| Небезпеки | |
| Класифікація ЄС | |
| R-фрази | 11-23/25-41 |
| S-фрази | 16-36/37/39-45 |
| Головні небезпеки | токсична, з неприємним запахом |
| Пов'язані речовини | |
| Інші (гетероцикли) | оксиран азірідин |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Синтез
Він синтезується із реакції взаємодії етилен карбонату та KSCN.[1] Для цього методу KSCN спочатку плавлять у вакумі для видалення води.
- KSCN + C2H4O2CO > KOCN + C2H4S + CO2
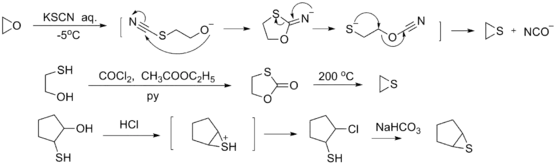
Реакційна здатність
Етиленсульфід взаємодіє з амінами до утворення 2-меркаптоетиламінів,[2] які є добрими хелатуючими лігандами.
- C2H4S + R2NH > R2NCH2CH2SH
Примітки
- Searles, S.; Lutz, E. F.; Hays, H. R.; Mortensen, H. E. "Ethylenesulfide" Organic Syntheses, 1973, Collective Volume 5, page 562.
- R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4.
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.