Церитиніб
Церитиніб (INN: Ceritinib) — це рецептурний інгібітор кінази анапластичної лімфоми (ALK), який використовується для лікування недрібноклітинного раку легені (НДРЛ). Ця діюча речовина входить до препарату Зікадія, який у квітні 2014 року дозволило застосовувати Управління з продовольства і медикаментів США (FDA).[2][3]
 | |
| Систематична назва (IUPAC) | |
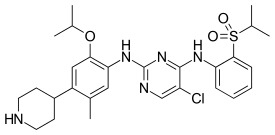
| 5-Chloro-N2-{5-methyl-4-(piperidin-4-yl)-2-[(propan-2-yl)oxy]phenyl}-N4-[2-(propane-2-sulfonyl)phenyl]pyrimidine-2,4-diamine | |
| Ідентифікатори | |
| Номер CAS | |
| Код ATC | L01 |
| PubChem | |
| DrugBank | |
| Хімічні дані | |
| Формула | C28H36ClN5O3S |
| Мол. маса | ? |
| SMILES | & |
| Синоніми | LDK378 |
| Фармакокінетичні дані | |
| Біодоступність | Не визначено |
| Зв'язування | 97% |
| Метаболізм | CYP3A |
| Період напіврозпаду | 41 hours |
| Виділення | із калом (92.3%) і сечею (1.3%)[1] |
| Терапевтичні застереження | |
| Licence data |
|
| Кат. вагітності |
D(США) |
| Лег. статус | |
| Використання | Перорально (капсули) |
Розробка
Гібридний ген ALK вперше було виявлено у 1994 році Стівом Морісом. У 1997 році ALK було повністю секвеновано.[4] Згодом Novartis Pharmaceuticals Corporation почала розробку таргетних інгібіторів ALK. У квітні 2014 року FDA за прискореною процедурою надала дозвіл на застосування церитиніба у хворих з ALK-позитивним НДРЛ, у яких відзначалася непереносимість кризотонібу (препарат Xalkori компанії Pfizer) або прогресія хвороби.[5]
АТС-класифікація
До початку 2021 року за АТС-класифікацією Церитиніб класифікувався як L01XE28. З 2021 року код ATC діючої речовини — L01ED02.[6]
Фармакологія
Церитиніб пригнічує мутований білок ALK, який набув онкогенної форми, та зупиняє прогресування НДРЛ.[7] Препарат підходить лише пацієнтам з мутацією ALK. Кандидати для лікування визначаються тестом VENTANA ALK (D5F3) CDx Assay компанії Roche.[8]
Протипоказання та побічні дії
Підвищена чутливість до компонентів препарату.[9]
Серйозні побічні дії включають токсичну дію на шлунково-кишковий тракт, гепатотоксичність, інтерстиціальне захворювання легень, синдром подовженого інтервалу QT, гіперглікемію, брадикардію, панкреатит.[10]
Найчастіші побічні ефекти: діарея, нудота, підвищення рівня печінкових ферментів, блювання, біль у животі, загальна слабкість, зниження апетиту, закрепи.[1]
Примітки
- Zykadia (ceritinib) Capsules, for Oral Use. Full Prescribing Information. Novartis Pharmaceuticals Corporation. Процитовано 14 лютого 2017.
- FDA Approves Ceritinib for ALK-Positive Lung Cancer. Medscape. 29 квітня 2014.
- FDA Expands Ceritinib Approval for Lung Cancer. National Cancer Institute. 27 червня 2017.
- Andraos E, Dignac J, Meggetto F. NPM-ALK: A Driver of Lymphoma Pathogenesis and a Therapeutic Target. // Cancers. — 2021. — Volume 13. — Issue 1. — https://doi.org/10.3390/cancers13010144
- Khozin S., Blumenthal G.M., Zhang L., Tang S., Brower M., Fox E., Helms W., Leong R., Song P., Pan Y., Liu Q., Zhao P., Zhao H., Lu D., Tang Z., Hakim A.A., Boyd K., Keegan P., Justice R., Pazdur R. (June 2015). FDA approval: ceritinib for the treatment of metastatic anaplastic lymphoma kinase-positive non-small cell lung cancer. Clinical Cancer Research 21 (11): 2436–9. PMID 25754348. doi:10.1158/1078-0432.CCR-14-3157.
- ATC/DDD alterations 2021 // WHO Collaborating Centre for Drug Statistics Methodology. — 2020. — 27 November
- Analplastic lymphoma kinase (ALK) fusion oncogene positive non-small cell lung cancer. UpToDate. Wolters Kluwer. Процитовано 30 жовтня 2017.
- Roche announces FDA approval of companion diagnostic to identify ALK-positive non-small cell lung cancer patients. diagnostics.roche.com.
- Rx index — Довідник еквівалентності лікарських засобів [Текст] / За ред. І.А. Зупанця, В.П. Черниха: Довідкове, спеціалізоване, медичне, фармацевтичне видання 4-те вид. доп. та перероб. — К.: Фармацевт Практик, 2020. — С. 516.
- Au T.H., Cavalieri C.C., Stenehjem D.D. Ceritinib: A primer for pharmacists [Електронний ресурс] // Oncology pharmacy practice. — 2017. — Vol. 23(8). — P. 611 (doi: 10.1177/1078155216672315)