Сірка
Сі́рка, су́льфур[1] (лат. sulfur, хімічний знак — ) — хімічний елемент з атомним номером 16, що належить до 16-ї групи, 3-го періоду періодичної системи хімічних елементів.
Проста речовина — сі́рка, неметал, жовта кристалічна речовина. Трапляється в природі в самородному стані та у вигляді сульфідів важких металів, піриту та інших. Сірку застосовують переважно у хімічній промисловості для виробництва сірчаної кислоти, синтетичного волокна, сірчистих барвників, димного пороху, у гумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
Завдяки здатності створювати дисульфідні зв'язки, сірка виконує важливу роль у складі білків. Ртуть порушує ці зв'язки, тому вона є токсичною[2].
Історія
Елементарну природу сірки встановив Антуан Лавуазьє в своїх дослідах зі спалювання.
Загальна характеристика
Сульфур має атомну масу 32,06. У природі існує 4 стабільних ізотопи з масовими числами 32-34 і 36. Науковцям вдалось отримати нестабільні ізотопи сульфуру з атомною масою 49[3][4].
Сульфур належить до халькогенів, за новою класифікацією до 16-ї, а за старою до VI групи елементів періодичної таблиці. Сірка є неметалом.
Відомі кілька алотропних форм сірки. За звичайних умов стабільною є ромбічна сірка — блідо-жовтого кольору, з густиною 2070 кг/м3, tплав = 112,8оС, tкип = 444,6оС. У всіх рідких і твердих станах сірка діамагнітна. Термодинамічні та інші властивості сірки різко змінюються при 160 °C, що пов'язано зі зміною молекулярної будови рідкої сірки. В'язкість сірки з підвищенням температури сильно зростає (від 0,0065 Па•с при 155 °C до 93,3 Па•с при 187 °C), а потім падає (до 0,083 Па•с при 444,6 °C).
Сірка реагує майже з усіма металами.
Поширення в природі
Сульфур — досить поширений елемент, на нього припадає близько 0,1 % маси земної кори. Середній вміст Сульфуру в земній корі 4,7•10−2 мас.%, при цьому основна кількість природної сірки зосереджена в осадових гірських породах (0,3 мас.%). У інших гірських породах середній вміст сірки такий: дуніти, перидотити, піроксеніти — 0,01 %; базальти, габронорити, діабази — 0,03 %; діорити, андезити — 0,02 %.
В природі Сульфур зустрічається як у вільному стані — так звана самородна сірка, але значно частіше зустрічається в зв'язаному вигляді, тобто у вигляді різних сполук. Найважливіші з них — залізний колчедан, або пірит FeS2, цинкова обманка ZnS, свинцевий блиск PbS, мідний блиск Cu2S, гіпс CaSO4 · 2H2O, мірабіліт Na2SO4 ·10H2O тощо.
Сульфур міститься в кам'яному вугіллі і нафті, а також в усіх рослинних і тваринних організмах, оскільки входить до складу білків.
Вміст Сульфуру в нафті і природному газі оцінюється в 2•109 т, тобто більше, ніж запаси природної сірки. Сульфур в нафті присутній у різній формі, від елементної сірки і сірководню до сірчистої органіки, що включає понад 120 сполук. Основні сірковмісні речовини вуглеводневої сировини — сірководень, меркаптани та інші сіркоорганічні сполуки. Сировинною базою для одержання сірки є, як правило, гази з вмістом сірководню не менше 0,1 %.
Звичайно самородна сірка зустрічається суцільною масою, заповнюючи тріщини і порожнини в гірських породах, або у вигляді натічних, кулястих і гніздоподібних аґреґатів, сталактитів, сталагмітів, нальотів, вицвітів, землистих порошкуватих скупчень. Нерідко вона утворює кристали, які часто згруповуються в зростки, друзи, щітки.
Див. також Родовища самородної сірки.


Фізичні властивості


Сірка — кристалічна речовина жовтого кольору. Вона дуже крихка і легко розтирається в дрібнесенький порошок. Густина 2070 кг/м3. tплав = 112,8оС, tкип = 444,6оС. У всіх рідких і твердих станах сірка діамагнітна.
Зустрічається в трьох алотропних формах: дві кристалічні (ромбічна і моноклінна, за способом сполучення атомів у кристалі) і аморфна.
- α-S (ромбічна) кристалічна модифікація, tплав = 112,8 °C, стійка до 95,6 °C, лимонно-жовта;
- β-S кристалічна модифікація, tплав = 119 °C, стійка при 95,6-119 °C, медово-жовта. До 160 °C молекули 8-атомні, в парах — 2-атомні (парамагнітна сірка), 4-, 6-, і 8-атомні.
- Вище 160 °C утворюються спіральні ланцюги μ-S пластичної сірки.
Електричного струму і тепла сірка майже не проводить. Пари сірки при дуже швидкому охолодженні переходять у твердий стан у вигляді дуже тонкого порошку (сіркового цвіту), минаючи рідкий стан. У воді сірка не розчиняється і не змочується водою, але в бензолі C6H6 і особливо в сірковуглеці CS2 розчиняється добре.
Хімічні властивості
Маючи в зовнішньому шарі шість електронів: (+ 16), 2,8,6 — атоми Сульфуру проявляють властивості окисника і, приєднуючи від атомів інших елементів два електрони, яких їм не вистачає до повністю заповненої зовнішньої оболонки, перетворюються в негативно двовалентні іони: S0 + 2е = S2-. Але Сульфур — менш активний окисник, ніж Оксиген, оскільки його валентні електрони віддаленіші від ядра атома і слабіше з ним зв'язані, ніж валентні електрони атомів Оксигену. На відміну від Оксигену Сульфур може проявляти властивості і відновника: S0 — 6e = S6+ або S0 — 4e = S4+. Відновні властивості Сульфуру виявляються при взаємодії з сильнішим від нього окисником, тобто з речовинами, атоми яких мають більшу спорідненість до електрона.
Сульфур може безпосередньо реагувати майже з усіма металами (за винятком благородних), але переважно при нагріванні. Так, якщо суміш порошків сірки й заліза нагріти хоч в одному місці, щоб почалася реакція, то далі вся суміш сама собою розжариться (за рахунок теплоти реакції) і перетвориться в чорну крихку речовину — моносульфід заліза:
- Fe + S = FeS
Суміш порошків сірки й цинку при підпаленні реагує дуже бурхливо, зі спалахом. Внаслідок реакції утворюється цинк сульфід:
- Zn + S = ZnS
Із ртуттю сірка реагує навіть при звичайній температурі. Так, при розтиранні ртуті з порошком сірки виникає чорна речовина — меркурій(ІІ) сульфід:
- Hg + S = HgS
При високій температурі сірка реагує також з воднем з утворенням сірководню:
- H2 + S = H2S.
При взаємодії з металами і воднем сірка відіграє роль окисника, а сама відновлюється до іонів S2- Тому в усіх сульфідах Сульфур негативно двовалентний. Сірка порівняно легко реагує і з киснем. Так, підпалена сірка горить на повітрі з утворенням діоксиду сірки SO2 (сульфітного ангідриду) і в дуже незначній кількості триоксиду сірки SO3 (сульфатного ангідриду).
- S + O2 = SO2
- 2S + 3O2 = 2SO3
При цьому окисником є Оксиген, а Сульфур — відновником. У першій реакції атом Сульфуру втрачає чотири, а в другій — шість валентних електронів, внаслідок чого Сульфур у сполуці SO2 позитивно чотиривалентний, а в SO3 — позитивно шестивалентний.
Органічні похідні
Головними класами органічних похідних Сульфуру є:
тіоли RSH, (їх ще називають меркаптанами),
тіоетери R-S-R',
сульфоксиди R-S(=O)-R',
похідні сульфатної кислоти R-O-SO2-O-R',
сірковмісні гетероциклічні сполуки.
- Приклади органічних сполук сірки
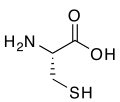 (R)-Цистеїн, амінокислота що містить тіольну групу
(R)-Цистеїн, амінокислота що містить тіольну групу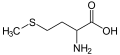 Метіонін, амінокислота що містить тіоетерну групу
Метіонін, амінокислота що містить тіоетерну групу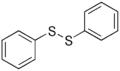 Дифеніл дисульфід, типова сполку з дисульфідним зв'язком
Дифеніл дисульфід, типова сполку з дисульфідним зв'язком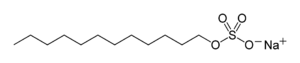 Додецилсульфат натрію, детергент, що застосовується в багатьох мийних засобах
Додецилсульфат натрію, детергент, що застосовується в багатьох мийних засобах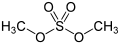 Диметилсульфат, сильно канцерогенний метилюючий агент, приклад диестеру сульфурної кислоти
Диметилсульфат, сильно канцерогенний метилюючий агент, приклад диестеру сульфурної кислоти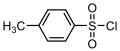 Тозилхлорид, приклад сульфонілхлориду
Тозилхлорид, приклад сульфонілхлориду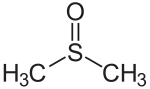 Диметилсульфоксид, полярний апротонний розчинник, приклад сульфоксиду
Диметилсульфоксид, полярний апротонний розчинник, приклад сульфоксиду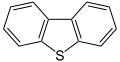 Дибензотіофен, компонент сирої нафти, приклад сірковмісної ароматичної гетероциклічної сполуки
Дибензотіофен, компонент сирої нафти, приклад сірковмісної ароматичної гетероциклічної сполуки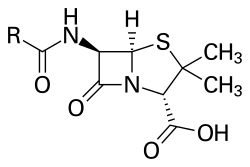 Пеніцилін, антибіотик, приклад сірковмісної аліфатичної гетероциклічної сполуки
Пеніцилін, антибіотик, приклад сірковмісної аліфатичної гетероциклічної сполуки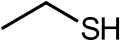 Етантіол, сильнопахнуча речовина яку додають в природний газ для створення запаху
Етантіол, сильнопахнуча речовина яку додають в природний газ для створення запаху
Сульфур входить до складу білків, сірковмісних амінокислот (цистеїн, цистин, метионін), є складовою частиною сульфгідрильних груп (), гормонів (інсулін), вітамінів (вітамін В1). Багато сірки у каротині волосся, шерсті, кістках, нервовій тканині тощо. У організмі сірка окислюється з утворенням ендогенної сірчаної кислоти, яка бере участь у нейтралізації отруйних сполук, які утворюються у кишечнику з амінокислот (фенол, крезол, скатол, індол), а також чужорідних сполук, наприклад лікарських препаратів. Тіоли проявляють захисні властивості відносно окисників й активних радикалів. При м'якому окисленні тіолів відбувається утворення дисульфідів:
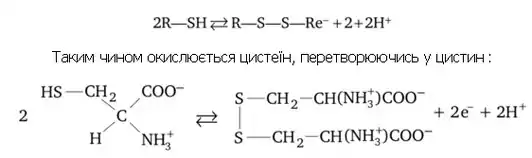
Цистеїнвмісткі білки утворюють дисульфідні зв'язки, внаслідок чого змінюються їх конформація та біологічна функція. Для захисту таких білків у організмі існують та звані тіолові протектори: глутатіон трипептид, який містить цистеїн, і дигідроліпоєва кислота. Окислюючись самі, вони захищають від окислення білків, тобто «беруть удар» на себе. Оскільки процес окислення є зворотним, то у організмі підтримується тіол-дисульфідна рівновага, яка дозволяє регулювати активність ферментів, гормонів та згортання крові, проникність мембран[5][6][7]. Тіолові протектори захищають організм від радіаційного ураження. Тіоли є також нуклеофільними реагентами, завдяки високій поляризовуваності сірки, тому у організмі вони активно взаємодіють із алкілуючими реагентами, у тому числі й з отруйними речовинами, нейтралізуючи їх дію.
Внаслідок великої спорідненості йонів срібла до тіолових груп, аргентум(І) нітрат використовують у титриметричному аналізі для якісного визначення груп, що дозволяє оцінювати буферну ємність антиоксидантної системи організму.
При процесах нагноєння рослинних й білкових речовин під дією мікроорганізмів утворюється сполука сірки — сірководень, який має запах гниючого білка й є дуже токсичним, оскільки є інгібітором ферменту цитохромоксидази (який переносить електрони у дихальному ланцюгу, зв'язуючи йони міді у її складі). Він блокує перенесення електронів з цитрохромоксидази на кисень. При вмісті у повітрі мг/л сірководню виникають головний біль, біль у очах, а при вмісті 1 мг/л — судоми, втрата свідомості й параліч дихання.
Одержання
Сірку одержують з самородних руд, а також у вигляді побічного продукту при переробці поліметалічних руд, з сульфатів при їх комплексній переробці, з природних газів і горючих копалин при їх очищенні. Частка сірки отримана з сірководню зростає. Для відокремлення сірки від сторонніх домішок її виплавляють в автоклавах. Автоклави — це залізні циліндри, в які завантажують руду і нагрівають перегрітим водяним паром до 150°С під тиском 6 атмосфер. Розплавлена сірка стікає вниз, а пуста порода залишається. Виплавлена з руди сірка ще містить певну кількість домішок.
Цілком чисту сірку одержують перегонкою у спеціальних печах, сполучених з великими камерами. Пари сірки в холодній камері відразу переходять в твердий стан і осідають на стінках у вигляді дуже тонкого порошку ясно-жовтого кольору. Коли ж камера нагрівається до 120°С, то пари сірки перетворюються в рідину. Розплавлену сірку розливають у дерев'яні циліндричні форми, де вона і застигає. Таку сірку називають черенковою.
Застосування
Сірка широко застосовується у різних галузях народного господарства, переважно у хімічній промисловості для виробництва сульфатної кислоти H2SO4 (майже половина сірки, що добувається в світі), сірковуглецю CS2, деяких барвників, і інших хімічних продуктів. Значні кількості сірки споживає гумова промисловість для вулканізації каучуку, тобто для перетворення каучуку в гуму.
Сірку використовують у хімічній промисловості при виробництві фосфорної, хлоридної та інших кислот, в ґумовій промисловості, виробництві барвників, димного пороху тощо. Самородну сірку використовують у сільському господарстві (інсектициди, мікродобрива, як дезінфекційний засіб у тваринництві).
Технічна сірка, що застосовується для виробництва сірчаної кислоти, повинна містити не менше 95 % Сульфуру, Арсену і Селену не повинно бути зовсім, а вміст органічних речовин не повинен перевищувати 1 %. Виробництво штучного волокна (віскози) в хімічній промисловості є іншим споживачем сірки. У сільському господарстві сірку застосовують як засіб боротьби з шкідниками, частково як добриво, для дезінфекції при лікуванні тварин. У паперовому виробництві сірку у вигляді SO2 використовують при обробці деревної маси (бісульфатний метод). Сірка використовується при вулканізації гуми, у скляній, шкіряній промисловості. Незначні кількості сірки високої чистоти використовуються в хіміко-фармацевтичній промисловості. Сірку використовують також для виробництва ультрамарину. Текстильна, харчова, крохмальна і патокова галузі промисловості застосовують сірку або її сполуки для вибілювання і прояснення, при консервації фруктів, у холодильній справі.
Сірку використовують також у сірниковому виробництві, у піротехніці, у виробництві чорного пороху тощо. У медицині сірка йде для виготовлення сіркової мазі при лікуванні шкіряних хвороб. У сільському господарстві сірковий цвіт застосовують для боротьби зі шкідниками бавовнику й виноградної лози.
Безелектродний розряд у плазмі сірки випромінює потужне світло зі спектром, близьким до спектра сонячного світла, майже без інфрачервоної і ультрафіолетової складових. Це використовується в сірчаній лампі.
Вплив на людину
Сірчаний пил подразнює органи дихання, слизові оболонки. ГДК — 2 мг/м. куб. од
Див. також
Примітки
- Національний стандарт України ДСТУ 2439:2018 «Хімічні елементи та прості речовини. Терміни та визначення основних понять, назви й символи». — [Чинний від 01.10.2019.] — К. : ДП «УкрНДНЦ», 2019. — С. 2.
- Jonathan G. Melnick, Kevin Yurkerwich, Gerard Parkincorresponding - On the Chalcogenophilicity of Mercury: Evidence for a Strong Hg–Se Bond in [TmBut]HgSePh and its Relevance to the Toxicity of Mercury.
- Researchers discover heaviest known calcium atom; eight new rare isotopes discovered in total. Phys.org. 12 липня 2018.
- O. B. Tarasov et al, Discovery of Ca60 and Implications For the Stability of Ca70, Physical Review Letters (2018). DOI: 10.1103/PhysRevLett.121.022501
- Michael C Yi, Chaitan Khosla - Thiol-Disulfide Exchange Reactions in the Mammalian Extracellular Environment.
- Lars I Leichert, Ursula Jakob - Global methods to monitor the thiol-disulfide state of proteins in vivo.
- Е.В.Калинина, Н.Н.Чернов, М.Д.Новичкова - Роль глутатиона, глутатионтрансферазы и глутаредоксина в регуляции редокс-зависимых процессов.
Література
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2013. — Т. 3 : С — Я. — 644 с.
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
Посилання
- Сірка // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- СІРКА //Фармацевтична енциклопедія
- Сірка // Українська мала енциклопедія : 16 кн. : у 8 т. / проф. Є. Онацький. — Накладом Адміністратури УАПЦ в Аргентині. — Буенос-Айрес, 1965. — Т. 7, кн. XIV : Літери Сен — Сті. — С. 1748. — 1000 екз.
