Атомна теорія
Атомна теорія — фізична теорія, яка припускає, що все на світі складається з найдрібніших частинок — атомів, сполучених між собою ядерними та електромагнітними силами. У XX столітті на практиці було доведено, що атом можна розділити на ще більш дрібні — субатомні — частинки.
Історія
Атомізм
У давньогрецькій філософії, а пізніше і в середні віки, люди припускали, що речі навколо них складаються з двох частин: неподільні атоми, якимось чином зчеплені один з одним, і з порожнечі між атомами. Атоми вважали вічними та незруйновними корпускулами.[1][2] Цю позицію відстоювали у своїх працях такі філософи, як Демокріт або Левкіпп, але жодних доказів ця теорія тоді не мала.
Перша теорія будови атома
Наприкінці XVIII століття було відкрито хімічні закони збереження:
- Закон збереження маси, який відкрив 1789 року Антуан Лоран Лавуазьє, свідчить, що маса реактивів під час хімічної реакції не змінюється;[3]
- Закон сталості складу, відкритий 1799 Жозефом Луї Прустом, свідчить, що будь-яка певна хімічна сполука, незалежно від способу її отримання, складається з одних і тих самих хімічних елементів;[4]
- Закон кратних відношень, який відкрив 1803 року Джон Дальтон, стверджує, що відношення маси одного елемента до іншого буде цілим числом.[5]

Ці закони не могли б виконуватися з такою точністю, якби матерія була дискретною структурою. Але в той час була не зовсім зрозумілою структура того, що ми тепер називаємо «молекулою». 1811 Амедео Авогадро провів серію дослідів з газом та з'ясував, що два літри гідрогену реагують лише з одним літром оксигену при отриманні водяної пари.[6] А після відкриття 1827 року броунівського руху,[7] стало очевидно, що матерія складається з окремих частинок — атомів, здатних утворювати групи — молекули, тобто була створена атомна теорія будови речовини.
Відкриття субатомних частинок
.png.webp)
До 1897 року атоми вважали неподільними. 1897 року Джозеф Джон Томсон провів досвід з круксовою трубкою,[8] в якому вперше спостерігався електрон. На катод подавали деяку напругу і, як згодом виявилося, в таких умовах катод випромінює пучки електронів. Томсон з'ясував, що ці пучки відхиляються при впливі на них електромагнітного поля. Сам Томсон називав ці частинки корпускулами, але пізніше вони отримали окрему назву — електрони.
Відкриття ядра атома
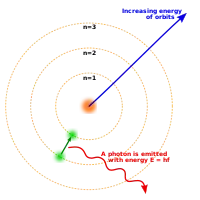
Модель атома Томсона спростував 1909 учень Томсона — Ернест Резерфорд. Він виявив, що атом не є однорідним за своєю структурою: в центрі розташоване масивне позитивно заряджене щільне ядро, а навколо нього, як планети навколо Сонця, рухаються електрони.
Виявилося, що якщо обстрілювати альфа-частками тонкий лист золота, то альфа-частинки будуть відхилятися на різні кути, причому частина з них — на кут більший ніж а це можливо лише якщо масивна позитивно заряджена альфа-частинка зустрічає на своєму шляху достатньо масивну позитивно заряджену перешкоду.[9]
Створення квантової теорії атома
Планетарна модель мала низку недоліків, з яких найістотніший був пов'язаний з теоретично правильною втратою енергії електрона: оскільки електрон обертається навколо атома, то на нього діє доцентрове прискорення, а за формулою Лармора будь-яка заряджена частинка, що рухається з прискоренням, випромінює. Тобто втрачає енергію. А якщо електрон втрачає енергію, то зрештою він повинен впасти на ядро, чого в реальності не відбувається.
1913 року Нільс Бор припустив, що електрон може обертатися не як завгодно, а по суворо визначених орбітах, не змінюючи своєї енергії як завгодно довгий час. Перехід з орбіти на орбіту вимагає певної енергії — кванта енергії.
Відкриття ізотопів
1907 року радіохімік Фредерік Содді виявив, що існують сполуки з однаковими хімічними властивостями, які відрізняються за кількістю нейтронів.
Відкриття подільності ядра
1930 року було виявлено, що якщо високоенергетичні альфа-частинки потрапляють на деякі легкі елементи, то останні випромінюють промені з надзвичайно великою проникною здатністю. Це випромінювання мало набагато більшу проникну здатність, ніж всі інші промені. 1932 Ірен та Фредерік Жоліо-Кюрі показали, що якщо це невідоме випромінювання потрапляє на парафін, то утворюються протони високих енергій, і ці енергії не збігаються з теоретичними розрахунками. Фізик Джеймс Чедвік припустив, що це випромінювання складається з незаряджених частинок з масою, близькою до маси протона, і провів серію експериментів, які підтвердили цю гіпотезу. Ці незаряджені частинки отримали назву нейтрони.
Відкриття атомних орбіталей

1924 року Луї де Бройль припустив, що всі частинки пов'язані з хвилею, названою згодом хвилею де Бройля з частотою і з довжиною хвилі
1926 року Ервін Шредінгер записав своє знамените рівняння Шредінгера,[10] яке описує субатомні частинки як хвилі. Трохи пізніше Макс Борн припустив, що корпускулярно-хвильовий дуалізм дійсний не лише для фотонів, але в принципі й для всіх частинок. Було введене поняття орбіталі — місце найбільш ймовірного знаходження електрона цього атома. Теоретично електрон можна дуже рідко виявити на якийсь конкретній відстані від ядра,[11] але найчастіше він розташований десь поруч з ним, якраз «на орбіталі».
Теорія будови атома в культурі
- Достатньо відомий вислів Р. Фейнмана:
| Якби внаслідок якоїсь світової катастрофи всі накопичені наукові знання виявилися б знищеними, і до прийдешніх поколінь живих істот перейшла б лише одна фраза, то, яке твердження, складене з найменшого числа слів, принесло б найбільшу інформацію?
Я вважаю, що це-атомна гіпотеза: всі тіла складаються з атомів — маленьких тілець, які перебувають у безперервному русі, притягуються на невеликих відстанях, але відштовхуються, якщо одне з них щільніше притиснути до іншого. В одній цій фразі міститься неймовірна кількість інформації про світ, варто лише прикласти до неї трохи уяви і трохи міркування. |
- Модель атома в спрощеному вигляді є одним з відомих символів науки.
Примітки
- Aristotle, Metaphysics I, 4, 985b 10—15.
- Berryman, Sylvia, «Ancient Atomism», The Stanford Encyclopedia of Philosophy (Fall 2008 Edition), Edward N. Zalta (ed.), http://plato.stanford.edu/archives/fall2008/entries/atomism-ancient/
- Weisstein, Eric W. Lavoisier, Antoine (1743-1794)]. scienceworld.wolfram.com. Архів оригіналу за 7 квітня 2013. Процитовано 1 серпня 2009.
- Proust, Joseph Louis. «Researches on Copper», excerpted from Ann. chim. 32, 26-54 (1799) [as translated and reproduced in Henry M. Leicester and Herbert S. Klickstein, A Source Book in Chemistry, 1400 — 1900 (Cambridge, MA: Harvard, 1952)]. Retrieved on August 29, 2007.
- Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, N.Y.: Dover Publications. ISBN 0-486-49584-1.
- Avogadro, Amedeo (1811.). Essay on a Manner of Determining the Relative Masses of the Elementary Molecules of Bodies, and the Proportions in Which They Enter into These Compounds. Journal de Physique 73: 58–76.
- Einstein, A. (1905). Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen. Ганнаlen der Physik 322 (8): 549. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806.
- Thomson, J.J. (1897). Cathode rays ([facsimile from Stephen Wright, Classical Scientific Papers, Physics (Mills and Boon, 1964)]). Philosophical Magazine 44 (269): 293. doi:10.1080/14786449708621070.
- Geiger, H (1910). The Scattering of the α-Particles by Matter. Proceedings of the Royal Society A 83: 492–504.
- Schrödinger, Erwin (1926). Quantisation as an Eigenvalue Problem. Ганнаlen der Physik 81 (18): 109–139. Bibcode:1926AnP...386..109S. doi:10.1002/andp.19263861802.
- Mahanti, Subodh. Max Born: Founder of Lattice Dynamics. Архів оригіналу за 22 січня 2009. Процитовано 1 серпня 2009.
