Гексан
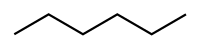
Гексан — насичений вуглеводень C6H14;
| Гексан | |
|---|---|
 | |
 | |
| Ідентифікатори | |
| Номер CAS | 110-54-3 |
| Номер EINECS | 203-777-6 |
| KEGG | C11271 |
| ChEBI | 29021 |
| RTECS | MN9275000 |
| SMILES |
СССССС |
| InChI |
InChI=1S/C6H14/c1-3-5-6-4-2/h3-6H2,1-2H3 |
| Номер Бельштейна | 1730733 |
| Номер Гмеліна | 1985 |
| Властивості | |
| Молекулярна формула | C6H14 |
| Молярна маса | 86,18 г/моль |
| Густина | 0,660 |
| Тпл | −95 |
| Ткип | 69 |
| Небезпеки | |
| Індекс ЄС | 601-037-00-0 |
| Класифікація ЄС | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Властивості
Безбарвна рідина зі слабким запахом. Показник заломлення п20D 1,37506. Враховуючи низьке октанове число (25) н-гексан — небажана складова бензину.
Графічне зображення
H H H H H H
| | | | | |
H - C - C - C - C - C - C - H
| | | | | |
H H H H H H
Отримання гексану
Гексан міститься в значних кількостях у бензині прямої перегонки і крекінг-дистилятах нафти.
Застосування
- В умовах ароматизації нафтопродуктів і каталітичного риформінгу н-гексан дегидроциклізується в бензол.
- 2,2-диметилбутан і 2,3-диметилбутан — використовуються як добавки до моторного палива, що покращують його якість.
- Застосовується при екстрагуванні рослинної олії
- Органічний розчинник
- Як знежирюючий агент
- Як неполярні розчини для проведення хімічних реакцій
- Як рідину в низькотемпературних термометрах
- У нафтовидобутку гексан — найкращий засіб для розчинення парафінових пробок.
- Застосовується гексан і в нанотехнології, зокрема нанопорошок заліза обов'язково змочують гексаном для запобігання самозайманню на повітрі
Ізомерія
Гексан має п'ять ізомерів:
| Назва | Формула | Температура плавлення | Температура кипіння |
| н-Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | −95.3 | 68.7 |
| 2-метилпентан (ізогексан) | CH3—CH(CH3)—CH2—CH2—CH3 | -153.7 | 60.3 |
| 3-Метилпентан | CH3—CH2—CH(CH3)—CH2—CH3 | -118 | 63.3 |
| 2,3-Диметилбутан (диізопропіл) | CH3—CH(CH3)—CH(CH3)—CH3 | -128.5 | 58 |
| 2,2-Диметилбутан (неогексан) | CH3—C(CH3)2—CH2—CH3 | −99.9 | 49.73 |
Джерела
- А.Вайсбергер, Е.Проскауер, Дж. Ріддік, Е.Тупс Органічні розчинники.- М.:Издатинлит, 1958.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.