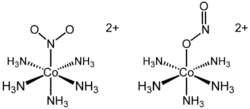Ізомерія
Ізомері́я (рос. изомерия, англ. isomerism, нім. Isomerie f) — існування сполук, однакових за хімічним складом, але різних за будовою і властивостями. Такі сполуки називають ізомерами. Залежно від характеру відмінностей у будові ізомерів розрізняють структурну ізомерію та просторову ізомерію.
Структурна ізомерія
Структура ізомерія виникає внаслідок розбіжностей в хімічній будові молекули. Розрізняють три підтипи структурної ізомерії.
Ізомерія вуглеводневого ланцюга (вуглецевого скелета)
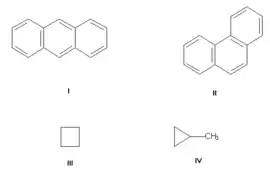
Ізомерія вуглецевого скелета, спричинена різним порядком зв'язку атомів вуглецю. Найпростіший приклад — бутан СН3-СН2-СН2-СН3 та ізобутан (СН3)3СН. Інші приклади: антрацен і фенантрен (формули C14H10, на малюнку справа I та II відповідно), циклобутан і метилциклопропан (формули C4H8, на малюнку справа III та IV відповідно).
Ізомерія положення
Ізомерія положення виникає внаслідок різного розташування однакової функціональної групи чи кратного зв'язку в однаковому вуглецевому скелеті. Приклад: 1-бутен і 2-бутен. Різновидом такої ізомерії є ізомерія взаємного положення, що спостерігається для сполук із більше ніж одною функціональною групою в молекулі. Це, зокрема, 2-хлорбутанова кислота CH3-CH2-CHCl-COOH і 4-хлорбутанова кислота CH2Cl-CH2-CH2-COOH.
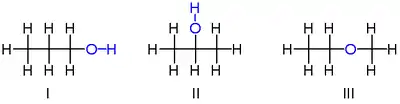
Існує три сполуки складу C3H7OH. Дві з них є ізомерами пропанолу (формули I,II), третя є етилметилетером (формула III):
Пропанол та метилетиловий етер належать до різних класів органічних сполук (спирти та етери відповідно), тому таку ізомерію інколи називають міжкласовою ізомерією. Такий тип ізомерії часто притаманний таутомерам.
Різне положення гетероатома у вуглецевому ланцюгу можуть називати метамерією. Приклад: CH3CH2OCH2CH3 — діетиловий етер і CH3OCH2CH2CH3 — метилпропіловий етер.
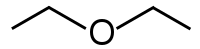 Діетиловий етер
Діетиловий етер Метилпропіловий етер
Метилпропіловий етер
В хімії комплексних сполук структурну ізомерію, що виникає як результат координації одного або більше лігандів з йоном металу більше ніж одним способом, можуть називати ізомерією зв'язування. Наприклад, у [SCN]– як атом S, так і атом N може виступати потенційним донорним центром: [S=C=N]–. Нижче наведено приклад ізомерних катіонів з різним типом зв'язування нітрит-аніону NO−2.
Інший тип структурної ізомерії комплексних сполук, спричинений включенням різних лігандів у першу координаційну сферу, називають іонізаційною ізомерією. Ця назва є наслідком того, що ліганди першої координаційної сфери відщеплюються чи заміщуються доволі повільно, отже, при електролітичній дисоціації іонізаційних ізомерів отримаємо різний склад розчину. Так, іонізаційними ізомерами є [Co(NH3)5Br]SO4 та [Co(NH3)5SO4]Br. Іонізаційні ізомери, які різняться положенням молекул води, можуть називати гідратними ізомерами.
Валентна ізомерія
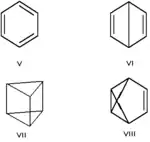
Валентна ізомерія — особливий вид структурної ізомерії, при якій ізомери можна перевести один в одного лише за рахунок перерозподілу зв'язків. Наприклад, валентними ізомерами бензену (V) є біцикло[2.2.0]гекса-2,5-дієн (VI, «бензен Дьюара»), призман (VII, «бензен Ладенбурга»), бензвален (VIII). Всі вони побудовані з однакового числа фрагментів CH, але ці фрагменти поєднані один із одним різними способами.
Просторова ізомерія
Просторова ізомерія спричинена різним розташуванням у просторі атомів молекул однакової хімічної будови. Розрізняють кілька підтипів просторової ізомерії. Якщо перехід між різними розташуваннями атомів у просторі дуже легкий, просторові ізомери називають конформерами; найчастіше це явище пов'язано з майже вільним обертанням навколо простого C-C-зв'язку.
Цис-транс ізомерія
Ізомерія, пов'язана з різним розташуванням замісників при подвійному зв'язку чи в насиченому циклі. Так, для 2-бутену відомі цис- і транс-ізомер. Термін застарілий, сучасна номенклатура IUPAC рекомендує використовувати універсальнішу систему E/Z позначень. Формально цис–транс ізомери належать до діастереомерів.
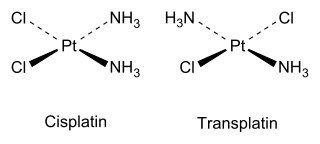
Цей тип ізомерії притаманний також чотирикоординованим плоскоквадратним комплексним частинкам, як-от комплекси платини:
Енантіомерія
Стереоізомери, молекули яких відносяться одна до одної як предмет до його відбитку в дзеркалі, називають енантіомерами чи оптичними ізомерами. Енантіомерам притаманні однакові фізичні та хімічні властивості, за винятком обертання площини поляризації плоскополяризованого світла. До енантіомерів можуть належати атропоізомери.
Діастереомерія
Діастереомерами вважають будь-яку пару просторових ізомерів, молекули яких не переводяться одна в одну відбиванням у дзеркалі. До діастереомерів належать цис-транс ізомери, ін-аут ізомери (біциклічної системи з досить довгими містками, так що екзоциклічні зв'язки чи вільні електронні пари біля голови містка можуть бути спрямованими як всередину, так і назовні структури), а також речовини, молекули яких містять більше одного хірального елементу й при цьому не є енантіомерами. До останніх належать аномери та епімери.
Джерела
- Изомерия // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1990. — Т. 2 : Даффа реакция — Меди сульфат. — Стб. 365. — Библиогр. в конце ст. — ISBN 5-85270-035-5.(рос.)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.