Гіпохлорит кальцію
Гі́похлори́т ка́льцію, ка́льцій гі́похлори́т — неорганічна сполука складу Ca(ClO)2. Речовина є білими кристалами, легко поглинає з повітря вологу та вуглекислий газ. Проявляє сильні окисні властивості.
| Гіпохлорит кальцію | |
|---|---|
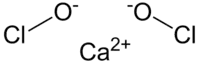 | |
| Ідентифікатори | |
| Номер CAS | 7778-54-3 |
| Номер EINECS | 231-908-7 |
| DrugBank | 15912 |
| ChEBI | 31342 |
| RTECS | NH3485000 |
| SMILES |
[O-]Cl.[O-]Cl.[Ca+2][1] |
| InChI |
InChI=1S/Ca.2ClO/c;2*1-2/q+2;2*-1 |
| Властивості | |
| Молекулярна формула | Ca(ClO)2 |
| Молярна маса | 142,982 г/моль |
| Зовнішній вигляд | білий порошок |
| Густина | 2,350 г/см³[2] |
| Тпл | 100 °C[2] |
| Розчинність (вода) | 1,3 г/л (20 °C)[2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Застосовується для відбілювання тканин, паперу, для знезараження води (дезінфекції), а також для синтезу інших гіпохлоритів.
Фізичні властивості
Гіпохлорит кальцію є білим кристалами. Сполука поглинає вологу з повітря, утворюючи гідрати із двома—чотирма молекулами H2O.
Вибухонебезпечний у присутності органічних сполук.
Отримання
Гіпохлорит кальцію отримують шляхом хлорування гідроксиду кальцію (гашеного вапна) із наступним розділенням суміші шляхом випарювання за низького тиску:
Застосовується метод обробки реакційної суміші гідроксидом натрію (каустичною содою) для уникнення утворення зайвих солей кальцію:
Використовується також обмінна реакція — взаємодія холодного гіпохлориту натрію та солей кальцію (або гідроксиду):
Хімічні властивості
Гіпохлорит кальцію, як й інші гіпохлорити, є малостійким. При нагріванні понад 175 °C він розкладається з виділенням кисню:
У гарячих розчинах гіпохлориту може відбуватися реакція диспропорціонування:
Утворені гіпохлоритом кристалогідрати дегідратуються при низьких температурах:
Якщо речовина зберігається у негерметичних контейнерах, вона поглинає з повітря вуглекислий газ:
При взаємодії із хлоридною кислотою виділяється газуватий хлор:
Гіпохлорит кальцію є сильним окисником. Він активно взаємодіє із сульфатною кислотою, виділяючи кисень:
Застосування
Основним застосуванням гіпохлориту кальцію є відбілювання тканин, паперу та дезінфекція води. Однак, його використання є обмеженим через схильність до взаємодії із вуглекислим газом в повітрі та, як наслідок, втраті окисних властивостей. Тому його використовують для синтезу більш стійкого та дорожчого гіпохлориту натрію.
Див. також
Примітки
- CALCIUM HYPOCHLORITE
- За тиску 101,3 кПа
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Farr J. P., Smith W. L., Steichen D. S. Bleaching Agents. Survey // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 4. — P. 143. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Sheikh S. A. Chlorine Oxides and Chlorine Oxygen Acids // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 5—6. — DOI: (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)
