Хімічна реакція
Хімі́чна реа́кція — це перетворення речовин, при якому молекули одних речовин руйнуються і на їхньому місці утворюються молекули інших речовин з іншим атомним складом. Усі хімічні реакції зображують хімічними рівняннями.
| Хімічна реакція | |
 | |
| |
Прослідкувати хід хімічних реакцій можна за допомогою лазерів ультракоротких імпульсів[1].
Загальна характеристика
Вихідні речовини, що вступають у хімічну реакцію, називаються реактантами (реагентами), а нові, які утворюються внаслідок такої реакції, — продуктами реакції.
Хімічні реакції завжди супроводжуються фізичними ефектами, що називаються ознаками хімічної реакції. До ознак хімічних реакцій, що зустрічаються найчастіше, належать:
- поглинання або виділення теплоти;
- зміна забарвлення реакційної суміші;
- утворення або розчинення осаду;
- виділення або поглинання газу;
- поява або зникнення запаху;
- виділення світла (світіння).
При хімічних реакціях загальна кількість атомів та ізотопний склад хімічних елементів не змінюються. Хімічні реакції можуть протікати мимовільно за звичайних умов, при нагріванні, за участі каталізаторів, при дії світла (фотохімічні реакції), електричного струму, іонізуючого випромінювання, механічних впливів, в низькотемпературній плазмі (плазмохімічні реакції) і т. д.
Розрізняють реакції сполучення (в ході яких із декількох речовин утворюється одна складна сполука), реакції розкладу (коли з однієї речовини утворюється кілька сполук), реакції заміщення (реакції, в ході яких більш проста речовина заміщує у складнішій якусь із її складових частин), реакції обміну (коли дві речовини обмінюються своїми складовими частинами).
Ендотермічні реакції відбуваються з поглинанням тепла, екзотермічні — з виділенням тепла.
Реакції можуть відбуватися як без зміни валентності елементів, що реагують, так і зі зміною валентності (так звані окисно-відновні реакції — вони супроводжуються переходом електронів від одного атома до іншого. Процес віддачі електронів називають окисненням, а приєднання їх — відновленням. Атоми, молекули та йони, які віддають електрони, називають відновниками, а ті, які приймають електрони — окисниками.
Розрізняють також прості і складні (зокрема ланцюгові) хімічні реакції. Крім того, існують необоротні та оборотні реакції.
За агрегатним станом розрізняють газо-, рідинно- та твердофазні хімічні реакції. Якщо вихідні речовини та продукти реакції знаходяться в одній фазі, реакцію називають гомогенною, якщо в різних — гетерогенною. Особлива група хімічних реакцій — топохімічні реакції, які протікають на поверхні розділу твердої фази.
Для назви хімічної реакції використовують назву функціональної групи, яка бере участь у процесі хімічного перетворення (з'являється або навпаки — зникає), наприклад, нітрування, декарбоксилювання. Інколи назва хімічної реакції відображає структурні зміни молекул речовини — ізомеризація, циклізація тощо. Ряд хімічних реакцій мають спеціальний характер і відповідну назву — реакція нейтралізації, гідроліз, горіння та ін.
Реакції зміни забарвлення розчину
- — тіоціанат заліза(III) червоного кольору
- — дихромат калію помаранчевого кольору
- — в осад випадає йодид свинцю(II) жовтого кольору
- — в осад випадає гідроксид нікелю зеленого кольору
- — в осад випадає гідроксид міді(II) блакитного кольору
- — аміакат міді(II) темно-синього кольору
- — тіоціанат кобальту(II) фіолетового кольору
Баланс у системі
Нехай у кожній точці системи локальна щільність її екстенсивної властивості (енергії, маси, ентальпії тощо) (наприклад, щільність маси ) є сталою величиною, однак змінюється з часом. Припустимо, у системі, яка складається з компонентів не відбувається жодна хімічна реакція. У цьому випадку макроскопічний закон збереження маси виглядає наступним чином:
де - щільність маси (скаляр), - швидкість компоненту (вектор).
Дивергенція вектора у полі дорівнює похідній по об'єму потоку поля через замкнену поверхню:
де - нормальна складова вектору до ділянки
Якщо нормаль додатна, спрямована поза поверхні, то додатне значення елементарного потоку крізь ділянку
буде означати витікання рідини з об'єму який знаходиться всередині поверхні а від'ємне - витікання рідини всередину цього об'єму. Потік крізь усю поверхню дорівнює інтегралу
Поділивши цей потік на об'єм обмежений поверхнею отримаємо усереднений потік на одиницю об'єму:
Якщо зменшити об'єм до нескінченно малої величини біля декотрої точки , отримаємо величину, як називається дивергенцією вектора у цій точці. У декартових координатах[2]
Тепер якщо просумувати рівняння по усім компонентам , отримаємо закон збереження повної маси (рівняння матеріального балансу):
де - повна щільність, - масова швидкість (швидкість центру мас), які визначаються співвідношеннями:
У рухомому потоці загальна зміна властивості, наприклад маси у елементі об'єму уздовж руху її центру мас, можна виразити як суму локальної зміни у нерухомому елементі об'єму й зміни, пов'язаної із переміщенням уздовж лінії руху:
Це співвідношення можна переписати у вигляді рівняння
оскільки
Відповідно з рівнянь та можна отримати інші форми виразу закону збереження повної маси:
де - питомий об'єм та
Нехай - концентрація відповідного компонента,
дифузійний потік цього компонента відносно руху центру мас
тоді рівняння запишеться у вигляді
Якщо у системі відбувається хімічна реакція, то потрібно додати джерела, які продукують компонент
де - швидкість -тої хімічної реакції, - кількість компоненту , який утворився у одиницю часу у одиниці об'єму у реакції
Із врахуванням джерел рівняння матеріального балансу буде мати вигляд:
Закон збереження енергії згідно до рівнянь вище запишеться наступним чином:
де - повна енергія, - повний потік енергії на одиницю маси.
Нехай повна питома енергія визначається сумою
де - питома кінетична енергія, - питома потенційна енергія та - питома внутрішня енергія. З макроскопічної точки зору містить лише енергію теплового руху й внесок короткодіючих сил[3].
У 1903 році Ейнштейн за допомогою розробленої ним теорії відносності довів, що маса тіла, яке рухається, перевищує його масу у стані спокою. При цьому виконується співвідношення:
де - маса, яка рухається, - маса у стані спокою, - швидкість руху частинки, - швидкість руху світла у вакуумі. Таким чином, збільшення швидкості руху тіла та, відповідно, збільшення його енергії приводить до збільшення маси. Ейнштейном було також доведено, що маса тіла пов'язана із його енергією
Не можна вважати, що цей закон свідчить про можливість перетворення маси у енергію і тим більше матерії у енергію. Маса та енергія - лише властивості матерії. Маса є мірою її інертності, енергія - мірою руху, тому вони не зводяться одна до одної і не перетворюються одна в одну. Перетворення матерії у рух означало б можливість руху без матерії, що є неприпустимим[4].
Класифікація хімічних реакцій
За типом перетворень
Хімічні реакції класифікуються за такими ознаками: 1) зміна або відсутність зміни кількості реагентів і продуктів реакції. За цією ознакою реакції поділяються на чотири основних типи:
- реакція сполучення — реакція, під час якої з двох або кількох речовин утворюється одна.
- реакція розкладу — реакція, під час якої з однієї речовини утворюється дві або кілька нових речовин.
- реакція заміщення — реакція між простою і складною речовинами, у процесі якої атоми простої речовини заміщують атоми одного з елементів у складній речовині, внаслідок чого утворюються нова проста і нова складна речовини.
- реакція обміну — реакція, у процесі якої дві складні речовини обмінюються своїми складовими частинами.
- багатостадійна реакція — реакцiя, що складається не менше, ніж із двох послiдовних елементарних стадiй (етапiв), де утворюється хоча б одна промiжна сполука. Синонім — поетапна реакція.
Такий розподіл, або класифікація, реакцій на окремі групи полегшує їх вивчення, оскільки реакції тієї чи іншої групи чи типу мають ряд спільних ознак. Більшість хімічних реакцій, що відбуваються в природі і техніці, являють собою досить складний комплекс різнотипних реакцій.
| Реакція | Загальна схема | Приклади |
|---|---|---|
| Сполучення | A + B → AB |
C + O2 → CO2 |
| Розкладу | AB → A + B |
2 H2O → 2 H2 + O2 |
| Заміщення | A + BC → B + AC |
Zn + CuSO4 → Cu + ZnSO4 |
| Обміну | AB + CD → AD + CB |
C2H5OH + HONO2 → C2H5ONO2 + H2O |
| Ізомеризації | Перегрупування атомів у молекулі |
α глюкоза β глюкоза |
Окрім того, існують взаємодії, в яких утворені продукти є хімiчно iдентичними до реактантів, наприклад, бiмолекулярна реакцiя обмiну:
- CH3I + I– →CH3I + I–
Такі реакції називають ідентичними або виродженими.
За зміною ступенів окиснення
Другою ознакою класифікації хімічних реакцій є зміна або відсутність зміни ступенів окиснення елементів, що входять до складу речовин, які реагують. За цією ознакою реакції поділяються на окисно-відновні та такі, які відбуваються без зміни ступенів окиснення елементів.
З точки зору електронної теорії валентності окисненням називається процес віддачі атомом, молекулою або іоном електронів, незалежно від того, бере кисень участь у реакції чи не бере. Процес приєднання атомом, молекулою або іоном електронів називається відновленням. Атом, молекула або іон, що віддає електрони, називаються відновником. Віддаючи електрони, сам відновник окиснюється. І навпаки, атом, молекула або іон, що приєднує електрони, називають окисником. Приєднуючи електрони, окисник відновлюється.
При окисно-відновних реакціях усі електрони, що втрачаються відновником, переходять до окисника. Тому загальна кількість електронів, відданих відновником, обов'язково повинно дорівнювати кількості електронів, приєднаних окисником. З цього виходить, що процеси окиснення і відновлення взаємно зв'язані і один без другого відбуватися не можуть. Кількість, відданих І приєднаних електронів знаходять за зміною валентності відповідних елементів. При цьому в рівняннях окисно-відновних реакцій над символами кожного елементу, що змінюють валентність, позначають їх валентність відповідною кількістю знаків плюс, мінус або нуль.
Прикладом окисно-відновної реакції є реакція окислення (розчинення) міді розбавленою нітратною кислотою:
- 3 Cu0(тв) + 2HN+5O3(aq) + 6HNO3(aq) → 3Cu+2(NO3)2(aq) + 2N+2O(г) + 4H2O (р)
Серед окисно-відновних реакцій виділяють:
- реакції диспропорціонування (самоокиснення-самовідновлення):
- 3AuF → 2Au (тв) + AuF3
- 4KClO3 → KCl + 3KClO4
- 3K2MnO4 + 2H2O → MnO2 + 2KMnO4 + 4KOH
- реакції внутрішньомолекулярного окиснення-відновлення:
- 2Ag2O → O2 (г) + 4Ag(тв)
- 2KClO3 → 2KCl + 3O2
- (NH4)2Cr2O7 → N2 (г) + Cr2O3 + 4H2O
- 2AgNO3 → 2Ag(тв) + 2NO2 + O2
- реакції міжмолекулярного окиснення-відновлення:
- H2 (г) + F2 (г) → 2HF
- KClO4 + 4C(тв) → KCl + 4CO
- KClO4 + 2C(тв) → KCl + 2CO2
- 3H2S + K2Cr2O7 + 4H2SO4 → 3S(тв) + Cr2(SO4)3 + K2SO4 + 7H2O
- 3C(тв) + 2KNO3 + S(тв) → 3CO2 + N2 (г) + K2S
- 3As2S3 + 28KNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + 28NO
За тепловим ефектом реакції
Наступною ознакою класифікації хімічних реакцій є виділення або поглинання енергії в процесі реакції. За цією ознакою реакції, що відбуваються з виділенням енергії (тепла), називаються екзотермічними. До них належить більшість хімічних реакцій. Наприклад, реакції сполучення заліза з сіркою, горіння магнію і фосфору в повітрі, гашення паленого вапна:
- Fe + 2S → FeS2
- 2Mg + О2 → 2MgO
- 4Р + 5О2 → 2Р2О5
- CaO (тв) + H2O (р) → Ca(ОН)2 (T = 298,15 K, P = 101,325 кПа; ΔH = −63,7 кДж/моль)
- 4C6H5NH2 (р) + 31O2 (г) → 24CO2 (г) + 14H2O (р) + 2N2(г) (T = 298,15 K, P = 101,325 кПа; ΔH = −13 584 кДж/(4 моль C6H5NH2))
Реакції, що відбуваються з вбираннями енергії (тепла), називаються ендотермічними. До них відносять, наприклад, реакції утворення монооксиду азоту при взаємодії азоту і кисню і дисульфіду вуглецю при взаємодії вуглецю і сірки при високих температурах:
- C + 2S → CS2
- N2 (г) + O2(г) → 2NO(г) (T = 298,15 K, P = 101,325 кПа; ΔH = +180,8 кДж/(2 моль NO))
Відповідно до цього хімічні сполуки, що утворюються з простих речовин з виділенням енергії, називаються екзотермічними, а сполуки, що утворюються із вбиранням енергії, — ендотермічними. Екзотермічні речовини мають менший запас енергії порівняно з вихідними речовинами, а ендотермічні, навпаки, більший. Екзотермічні речовини, як правило, досить стійкі, причому чим більше енергії виділяється при їх утворенні, тим вони стійкіші. Ендотермічні речовини, навпаки, мало стійкі і легко розкладаються. Тому ендотермічних речовин відносно мало.
За типом реактантів
За типом реактантів реакції поділяються на реакції галогенування (взаємодія з хлором, бромом тощо), гідрування (приєднання молекул водню), гідратації (приєднання молекул води), гідролізу, нітрування.
Наявність каталізатора
За цією ознакою реакції поділяються на каталітичні (які відбуваються тільки за наявності каталізатора) і некаталітичні (які відбуваються без нього).
За ступенем перетворення реактантів
За цією ознакою реакції поділяються на необоротні, коли реактанти повністю перетворюються на продукти реакції, та оборотні, які не доходять до кінця.
Термохемічні процеси за лазерного нагрівання
Нехай у хімічному реакторі ідеального перемішування відбувається реакція
Рівняння кінетики цієї реакції має вигляд
де - концентрація продукту а - константи швидкості прямої та зворотної реакцій, які залежать від температури по закону Арреніуса:
Зміна температури середовища визначається з рівняння теплового балансу
де - поглинальна здатність середовища, - потужність випромінювання лазера, - теплота реакції, - потужність втрат, - константа теплоємності середовища.
Особливості лазерного нагрівання обумовлені явною залежністю поглинальної здатності середовища від його хемічного складу й температури, а також від довжини хвилі випромінювання.
Нехай реактор є оптично тонким у напрямку розповсюдження випромінювання. Тоді
де - сумарна кількість частинок речовин та у одиниці об'єму, - товщина реактора.
У видимому діапазоні енергія кванта лазерного випромінювання є великою, тобто залежність перетинів поглинання та від температури, як правило, є вельми слабкою й можна вважати, що Розглядувана система з будь-яких початкових умов приходить до декотрого стійкого стаціонарного стану. Не змінює цього висновку й врахування фотохемічних каналів за участі електронно-збуджених молекул. Кінцевих стаціонарних станів може бути декілька (це тягне за собою гістерезисні явища при зміні таких параметрів, як потужність й довжина хвилі випромінювання). Число стаціонарних станів змінюється при переході параметрів через декотрі критичні (біфуркаційні) значення, біля яких навіть невеликі їх зміни приводять до різкої зміни хемічного результату. Справа у тому, що стартуючи з одного й того ж початкового стану, система при переході через біфуркаційну точку отримує можливість попасти до області притягання інших кінцевих станів. У зв'язку із цим лазерне управління біля біфуркаційних значень не потребує великих витрат енергії. Навіть малі впливи можуть давати великий ефект.
У порівнянні із монотонним нагрівом у термостаті позитивний ефект за лазерного нагрівання досягається у результаті "своєчасного" підйому та скидання температури. З формально-математичної точки зору реакції полімідизації при нагріві у термостаті й за лазерного нагріву відрізняються числом моментів часу, у які швидкість реакції досягає екстремуму (біфуркації перехідних режимів). Такі немонотонні зміни швидкості за лазерного нагріву притаманні багатьом реакціям.
При переході від точкових до розподілених систем, де суттєву роль починають відігравати процеси тепло- й масоперенесення, діапазон можливих режимів різко розширюється. Наявність дифузії й теплопровідності може приводити до явищ спонтанної втрати симетрії й просторово-часової самоорганізації, а також до формування різних нерівноважних структур. Теоретично динамік відповідних процесів описується пов'язаними дифузійними рівняннями:
де - вектор стану, - матриця коефіцієнтів дифузії (у загальному випадку недіагональна, яка залежить від ), - вектор нелінійних джерел.
LCVD[5]
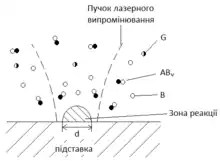
У багатьох експериментах по LCVD газова суміш є прозорою для лазерного випромінювання, а осад термічно тонкий.
У деяких випадках LCVD процес може представлятися реакцією мономолекулярного розкладу
де - молекула розкладуваного газу, - молекула газу, який розбавляє, - молекула (атом) речовини, яка утворює твердий осад, - молекула газоподібної фракції продукту реакції, - стехіометричний коефіцієнт. Прикладом такої реакції є процес утворення твердого вуглецю за піролізу метану й інших вуглеводнів, осад кремнію при піролізі моносилану. Швидкість таких реакцій описується законом мономолекулярного розкладу:
де - повна щільність молекули у газі, - концентрація речовини на поверхні осаду, - енергія активації хемічної реакції, - передекспониненційний множник, - стала Больцмана, - температура поверхні. За низьких температур концентрація речовини у всьому об'ємі практично однакова (кінетична область). За високих температур швидкість утворення осаду визначається темпом надходження реагенту реакції (дифузійна область)[6].
| Реакція | T, K | Діапазон тисків суміші, мбар | кДж/моль |
|---|---|---|---|
| 1900-2450 | 50-1000 | ||
| 2000-2250 | 300-1000 | ||
| 2200-2250 | 300-1000 | ||
| 2850-3100 | 500-1000 | ||
| 1000-1800 | 10-1000 |
Див. також
Джерела
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- Eintrag zu Reaktion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
Примітки
- П.Г.Крюков - Лазеры ультракоротких импульсов.
- Андре Анго - Математика для электро- и радиоинженеров, с.142.
- И.А.Семиохин - Физическая химия.
- Курта Сергій Андрійович - Будова речовини.
- Dieter Bäuerle, Linz - Laser Induced Chemical Vapour Deposition.
- Н.В.Карлов. Н.А.Кириченко, Б.С.Лукьянчук - Макроскопическая кинетика термохимических процессов при лазерном нагреве: состояние и перспективы.
