Гідроліз
Гідроліз (від дав.-гр. ὕδωρ — вода і λύσις — розкладання) — це розкладання речовин під дією води. Солі утворюються при взаємодії основи та кислоти та складаються з катіону металу (або амонію) та аніону кислотного залишку. Катіон — частина основи, аніон — частина кислоти. При гідролізі солей утворюються кислоти та луги. Органічні сполуки гідролізуються в присутності кислот (кислотний гідроліз) або лугів (лужний гідроліз).

В живій природі гідроліз молекул, в тому числі біополімерів, каталізують ферменти класу гідролаз. Залежно від типу зв'язку, що розщеплюється, гідролази підрозділяють на 13 підкласів.
Зворотна гідролізу реакція називається конденсацією.
Типи
Гідроліз — хімічний процес, окремий випадок сольволізу, в якому вихідні молекули розкладаються при участі молекули води з виходом нових речовин.
Найпоширеніший в неорганічній хімії тип гідролізу відбувається, коли сіль слабкої кислоти або слабкої основи (чи обидвох) розчиняють у воді. Сіль розпадається на позитивні і негативні іони. Наприклад, ацетат натрію дисоціює в воді на ацетат-аніони та катіони натрію. Іони натрію з іонами гідроксиду реагують дуже мало, в той час як ацетат-аніони сполучаються з іонами водню краще, з отриманням молекули оцтової кислоти. Кінцевим результатом є відносне переважання гідроксильних іонів, тобто середовище стає оснóвним.
Гідроліз солей
Гідроліз солей — різновид реакцій гідролізу, зумовлений протіканням реакцій іонного обміну в розчинах (переважно, водних) розчинних солей-електролітів. Рушійною силою процесу є взаємодія іонів з водою, що приводить до утворення слабкого електроліту в іонному або (рідше) молекулярному вигляді («зв'язування іонів»).
Розрізняють оборотний і необоротний гідроліз солей :
- Гідроліз солі слабкої кислоти і сильної основи (гідроліз за аніоном):
(Розчин має слаболужне середовище, реакція протікає оборотно, гідроліз по другому щаблі протікає в незначній мірі)
- Гідроліз солі сильної кислоти і слабкої основи (гідроліз за катіоном):
(Розчин має слабокисле середовище, реакція протікає оборотно, гідроліз по другому щаблі протікає в незначній мірі)
- Гідроліз солі слабкої кислоти і слабкої основи:
(Рівновага зміщена в бік продуктів, гідроліз протікає практично повністю, тому що обидва продукти реакції виходять із зони реакції у вигляді осаду чи газу).
Сіль сильної кислоти і сильної основи не піддається гідролізу, тому розчин нейтральний.
Ступінь гідролізу
Під ступенем гідролізу розуміють відношення кількості (концентрації) солі, яка піддається гідролізу, до загальної кількості (концентрації) розчиненої солі. Позначається α (або h гідр ); α = ( c гідр / c заг ) · 100 % де c гідр — число молей гідролізованої солі, c заг — загальна кількість молей розчиненої солі. Ступінь гідролізу солі тим вище, чим слабкіше кислота або основа, що її утворюють. Ступінь гідролізу зростає також із розведенням розчину та із ростом температури (зазвичай оборотно).
Гідроліз в органічній хімії
При нормальних умовах відбувається тільки кілька реакцій між водою та органічними сполуками. Загалом, сильні кислоти або луги додаються як каталізатори гідролізу, якщо сама вода не дає ніякого ефекту.
Кислотно/основно-каталізований гідроліз дуже поширений, одним із прикладів його є гідроліз амідів або естерів. Він відбувається, коли нуклеофіл (частинка з неподіленими парами електронів, наприклад, молекула води або гідроксильний іон) атакує вуглець карбонільної групи естеру чи аміду. У водному середовищі гідроксильні іони є кращими нуклеофілами, ніж диполі води. За умов кислотного каталізу карбонільні групи стають протонованими, і це призводить до спрощення нуклеофільної атаки. Продуктами гідролізу є сполуки, що містять карбоксильну групу.
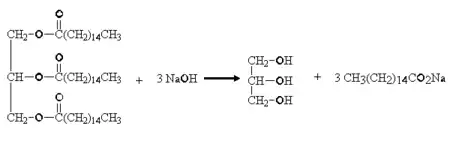
Класичний приклад гідролізу естеру — омилення. Це гідроліз тригліцеридів (жиру) з водної основи під дією, наприклад, гідроксиду натрію (NaOH). Під час процесу утворюється гліцерин, а жирні кислоти реагують з основами, перетворюючи їх у солі, які називаються милами і використовуються в домашньому господарстві.
Крім того, гідроліз — важливий процес у рослинних і тваринних організмах, найбільш значущі приклади — обмін речовин і зберігання енергії. Всі живі клітини вимагають постійного енергопостачання для двох основних цілей: біосинтезу макро- і мікромолекул та активного транспорту іонів і молекул через клітинні мембрани. Енергія, одержувана від окислення поживних речовин, не використовується безпосередньо там, де її було виділено, а направляється в спеціальні молекули зберігання енергії — аденозинтрифосфат (АТФ), — за допомогою складних і багатоступінчатих реакцій.
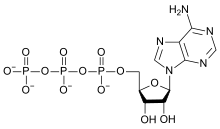
Молекули АТФ містять пірофосфатні зв'язки (утворені при об'єднанні двох одиниць фосфату), що виділяють енергію в процесі гідролізу. АТФ може піддаватися гідролізу двома способами: видалення кінцевого фосфату з утворенням аденозиндифосфату (АДФ) і неорганічного фосфату, або видалення кінцевого дифосфату з утворенням аденозинмонофосфату (АМФ) і пірофосфату. Пірофосфат може гідролізувати далі з утворенням орто-фосфатів. Виділена енергія дозволяє перебіг інших реакцій біосинтезу, які не відбуваються самовільно.
Крім того, в живих системах більшість біохімічних реакцій, в тому числі гідроліз АТФ, відбувається за умов ферментативного каталізу. Каталітична дія ферментів уможливлює гідроліз білків та жирів, біохімічне розщеплення олій і вуглеводів. Як приклад можна розглянути протеази, ферменти, що допомагають травленню, викликаючи гідроліз пептидних зв'язків у білках. Вони каталізують гідроліз пептидних зв'язків в пептидному ланцюзі, на відміну від екзопептидаз, які каталізують гідроліз кінцевого пептиду, звільнюючи окремі вільні амінокислоти.
Однак, протеази не каталізують гідроліз всіх видів білків. Їхня дія стереоселективна: поширюється тільки на білки з певною третинною структурою. Тому що необхідна певна орієнтація молекули, щоб амідна група перебувала у визначеному місці для каталізу. Ця специфіка зберігає цілісність інших білків, таких як гормони, і, отже, біологічна система продовжує функціонувати в звичайному режимі.
Див. також
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0