Ліганд (біохімія)
Ліганд — молекула, що оборотно з'єднана з білком не ковалентним зв'язком. Ліганд може бути будь-якою молекулою, що формує комплекс з білком, включаючи інші білки. Зв'язування з лігандом змінює просторову конформацію білка, при чому якщо білок складається з декількох субодиниць, зв'язування однієї з субодиниць з лігандом може змінити конформацію інших субодиниць. Змінена конформація призводить до зміненої функції білка, якщо це фермент — він може переходити в активну чи не активну форму, тощо.
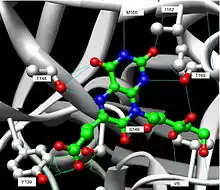
Білок-лігандні взаємодії
Білки є досить динамічними молекулами, чия 3D конформація не є стабільною і легко піддається змінам залежно від умов навколишнього середовища, таких як температура, кислотність, вміст солей тощо. Зміни конформації білка можуть бути незначними (це називається «білковим диханням»), а можуть переміщуватися субодиниці на відстані до декількох нанометрів. При зміні форми білка сильно змінюється його функціональність. Ліганди як раз впливають на форму білка.
Важливим в білково-лігандній взаємодії є саме тимчасовий, оборотний характер зв'язку, таким чином в клітині білкові молекули легко модифікуються та змінюють свої функції, активуються чи інактивуються, залежно від зв'язаних лігандів, і при цьому ці зміни тимчасові і легко повертаються у вихідне положення.
Місце зв'язування ліганду з білком називається сайтом зв'язування. Сайт зв'язування підходить до ліганду розміром, формою, зарядом та гідрофобними чи гідрофільними властивостями. При чому мінімальна хімічна зміна ліганду може сильно вплинути на здатність його зв'язуватися (афінність) з сайтом зв'язування. Також білки можуть мати декілька сайтів зв'язування для різних лігандів. В деяких випадках сайт зв'язування для ліганду є активним або не активним залежно від конформації цього білка. Так, одне з найпоширеніших білкових модифікацій, фосфорилювання чи дефосфорилювання білків часто відкриває або закриває можливості ліганду зв'язатись з цим білком.
Алостеричні взаємодії білків з лігандами є такими, при яких зв'язування ліганду з білком впливає на можливість білка зв'язуватися з іншими молекулами в інших сайтах.
У випадку ліганд-ферментної взаємодії сайт зв'язування ферментів з лігандом називається каталітичним чи активним сайтом.
Оскільки реакція ліганду й білка оборотна, рівняння рівноваги виглядає як:
де P — білок, L — ліганд, PL — комплекс ліганду й білка.
Реакція підпорядкована стандартній константа рівноваги, яка показує ступінь афіності ліганду до білка (чим більше константа рівноваги, тим більш споріднений цей ліганд до цього білка):
де [P] — концентрація вільного білка, [L] — концентрація не зв'язаного ліганду, [PL] — концентрація комплексу ліганду й білка.
Лігандкеровані іонні канали та білкові рецептори
Ліганди є активаторами лігандкерованих іонних каналів. У відповідь на зв'язування з лігандом, іонний канал відкривається. Залежно від типу іонного каналу, це призводить до потоку таких іонів, як Na+, K+, Ca2+, Cl- та ін. через клітинну мембрану. Активація лігандкерованих іонних каналів, як і решти іоннів каналів, призводить до різноманітної реакції клітин, від скорочення до генерації потенціалу дії.
Рецептори на відміну від іонних каналів не починають пропускати певні іони через мембрану, їхня дія опосередкована каскадом хімічних реакцій, який запускається від активації рецептора від зв'язування з лігандом. Типів рецепторів дуже багато, відповідь клітини на них різноманітна, багато гормонів діють саме на рецептори. Прикладом є дія нейромедіатора адреналіну через різноманітні α1-, α2-, β1-, β2-, β3-адренорецепторина різні тканини організму. При чому, адреналін приводить як до скорочення певних м'язів, так і до розслаблення інших груп м'язів, залежно від типу рецептору, який знаходиться в даній тканині. Таким чином, регулюючи експресію генів різних рецепторів організм змінює тип відповіді певних різновидів тканин на один і той же самий ліганд. Також прикладом ліганд-рецепторної взаємодії є гормон інсулін і інсуліновий рецептор.
Взаємодії лігандів і ДНК
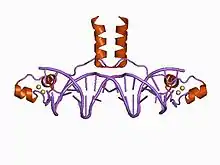
Лігандом також називається молекула, яка оборотно з'єднується з ДНК. Найтиповішим прикладом ліганд-ДНК взаємодій є зв'язки різних транскрипційних факторів з молекулою ДНК.
Вивчення лігандів
Один з основних напрямків досліджень науки біохімії як раз і займається взаємодією лігандів з білками загалом і ферментами зокрема.
Фармакологія
Фармакологічна дія більшості ліків забезпечена саме специфічністю дії певних медичних компонентів ліків на певні білки організму — в цьому випадку діюча речовина є лігандом. Активна частина фармакологічних досліджень полягає в біоінформатичному пошуку нових лігандів, які будуть більш селективно діяти на певні білки.
Джерела
- Lehninger, Albert (2005). Lehninger principles of biochemistry. New York: W.H. Freeman. ISBN 978-0-7167-4339-2.
- Moran, Laurence (2012). Principles of biochemistry. Boston: Pearson. ISBN 978-0-321-70733-8.