Ліганд (хімія)
Ліга́нд (від лат. ligo — зв'язую), адент — атом або група атомів, безпосередньо зв'язана з одним або декількома центральними атомами металу (комплексоутворювачами) в комплексній сполуці[1]. Ліганди становлять внутрішню координаційну сферу комплексної сполуки. Ліганди розрізняють за їхньою дентатністю — за числом здатних до координації електроно-донорних атомів (моно-, ди- і полідентантні).
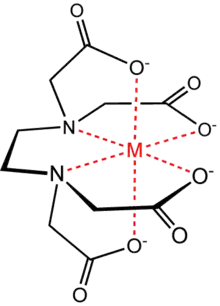
Комплекс металу з етилендиамінтетраацетатом, в якому останній є гексадентатним лігандом.
Різновиди
- ліганд π-акцепторний (рос. π-акцепторный лиганд, англ. π-acceptor ligand) — ліганд, що забирає електрони від центрального атома металу шляхом взаємодії незаповненої орбіталі ліганда із заповненою орбіталлю атома металу.
- ліганд π-донорний (рос. пи-донорный лиганд, англ. pi-donor ligand) — ліганд, що віддає електрони центральному атомові металу шляхом взаємодії заповненої орбіталі ліганда з незаповненою орбіталлю атома металу.
- Містковий ліганд — ліганд, який сполучає два або більше металічних центри в комплексах. Наприклад, в іоні октоаква-ді-µ-гідроксодиферум(ІІІ) такими лігандами є дві гідроксильні групи. Перед ними у формулі ставиться локант µ.
- Триподальний ліганд — ліганд, який містить три гілки, кожна з донорним атомом і відгалужується від центрального атома або групи.
- Бідентатний ліганд — ліганд, який має два атоми або центри, що координуються з одним центральним атомом у комплексі. Пр., 1,10-фенантролін є бідентатним лігандом заліза.
Джерела
- Глінка М. Л. Загальна хімія : підручник. — 2-ге вид., перероб. і доп. — Київ : Вища школа, 1982. — 608 с.
- Cotton, F. A. and Wilkinson, G., Advanced Inorganic Chemistry, John Wiley and Sons: New York, 1988. ISBN 9780471199575(англ.)
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.