Гаптичність ліганда
Гаптичність ліганда (англ. hapticity of ligand) — число суміжних атомів у ліганді (n), що безпосередньо зв'язані з центральним металічним атомом у комплексних сполуках.
Позначається ηn. Символ гапто ηn використовується для позначення гаптичності при описі топології зв'язування вуглеводнів (агостичні взаємодії)та інших π-електронних систем з металами, де степінь n позначає кількість атомів ліганду, зв'язаних з центральним атомом.[1]
Якщо ж цетральний атом металу зв'заний з кількома несуміжними атомами, тоді мова йде про дентатність.
Історія
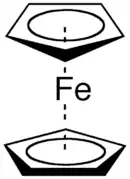
Потреба у цій термінології з'явилася в середині 1950-х, коли за допомогою рентгеноструктурного аналізу була вперше описана структура "сендвічної сполуки", фероцену[2] Ф. А. Коттон запропонував термін "гаптичність", що походив від префіксу "гапто-" (від гр. haptein, закріпити, що означає "контакт" чи "комбінація").[3]
Історично значимі сполуки з гаптичними лігандами
- Фероцен: біс(η5-циклопентадієн)заліза.
- Ураноцен: біс(η8-1,3,5,7-циклооктатетраєн)урану.
- W(CO)3(PPri3)2(η2-H2 ): перша сполука синтетизована з молекулою водню H2 в якості ліганда.[4]
- IrCl(CO)[P(C6H5)3]2(η2-O2): сполука, що містить молекулу кисню O2, і що оборотно формується при окисненні комплексу Васки (транс-карбонілхлоробіс(трифенілфосфін)іридію(I), з формулою IrCl(CO)[P(C6H5)3]2).
Зміна гаптичності
Гаптичність ліганда може змінюватися протягом реакції. Наприклад, у наступній окисно-відновній реакції відбувається зміна від η6-бензену до η4-бензену:[5]
Гаптичність може змінюватися і в ході реакції заміщення. У наступній реакції, η5-циклопентадієн змінюється до η3-циклопентадієну, звільнюючи місце у комплексі для додаткової пари електронів ліганду 'L'. Видалення однієї молекули CO та віддача двох електронів циклопентадієновим лігандом відновлює η5-циклопентадієн:
Так званий, інденіловий ефект описує зміну гаптичності ліганду в реакціях заміщення.

Гатичність і дентатність
Необхідно розрізняти терміни "гаптичність" і "дентатність".
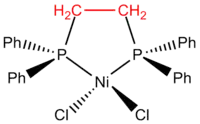
Дентатність: полідентатні ліганди координуються до атому металу через кілька несуміжних атомів. Тоді, використовується позначення κ "каппа" [6] Наприклад, при координації 1,2-біс(діфенілфосфіно)етану до NiCl2 формується діхлоро[етан-1,2-діілбіс(діфенілфосфан)-κ2P]нікелю(ІІ).
Гаптичність: якщо атоми, що координуються, є суміжними використовується позначення η "ета". Наприклад, в титаноцен діхлориді, діхлоробіс(η5-2,4-циклопентадієн-1-іл)титанію.[7]
Гаптичність і структуромінливість
Полігаптичні молекули є часто структуромінливими. Два типи мінливих структур є найбільш характерними для полігаптичних комплексів:
- Тип 1: коли гаптичність ліганду є нижчою від числа sp2-атомів карбону. У такому випадку, метал часто мігруватиме від одного карбону до іншого, зберігаючи при цьому ту ж гаптичність. Так атом заліза почергово зв'язується з кожним атомом карбону в η1-C5H5 ліганді в (η5-C5H5)Fe( η1-C5H5)(CO)2 комплексі.[8] Використовуючи термінологію органічної хімії, реакція є вироджена, і є прикладом сигматропного перегрупування. Подібним прикладом є біс(циклооктатетраєн)заліза, що містить кільця η4- і η6-C8H8.[9]
- Тип 2: коли комплекс містить циклічний полігаптичний ліганд максимальної гаптичності. Такі ліганди зазнають обертання. Відомим прикладом є фероцен, Fe(η5-C5H5)2,[10] в якому циклопентадієн має низький енергетичний бар'єр обертання.
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Примітки
- η (eta or hapto) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.). Процитовано 28.09.2020.
- J. Dunitz; L. Orgel; A. Rich (1956). The crystal structure of ferrocene. Acta Crystallographica 9 (4): 373–5. doi:10.1107/S0365110X56001091.
- F. Albert Cotton (1968). Proposed nomenclature for olefin-metal and other organometallic complexes. J. Am. Chem. Soc. 90 (22): 6230–6232.
- Kubas, Gregory J. (1 березня 1988). Molecular hydrogen complexes: coordination of a .sigma. bond to transition metals. Accounts of Chemical Research 21 (3). с. 120–128. ISSN 0001-4842. doi:10.1021/ar00147a005. Процитовано 28 вересня 2020.
- Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. (1971). Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0). Angewandte Chemie International Edition in English 10 (8): 556–557. doi:10.1002/anie.197105561.
- κ (kappa) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.). 28.09.2020.
- IR-9.2.4.1 Coordination Compounds: Describing the Constitution of Coordination Compounds: Specifying donor atoms: General. Nomenclature of Inorganic Chemistry – Recommendations 1990 (the 'Red Book') (вид. Draft March 2004). IUPAC. 2004. с. 16.
- O'Connor, Joseph M.; Casey, Charles P. (1 квітня 1987). Ring-slippage chemistry of transition metal cyclopentadienyl and indenyl complexes. Chemical Reviews 87 (2). с. 307–318. ISSN 0009-2665. doi:10.1021/cr00078a002. Процитовано 28 вересня 2020.
- Carbonaro, A.; Segre, A. L.; Greco, A.; Tosi, C.; Dall'Asta, G. (1 липня 1968). Oligomerization catalysts. II. Spectroscopic examination of bis(cyclooctatetraene)iron. Journal of the American Chemical Society 90 (16). с. 4453–4455. ISSN 0002-7863. doi:10.1021/ja01018a045. Процитовано 28 вересня 2020.
- Bunker, P.R. (1965). The Vibrational Selection Rules and Torsional Barrier of Ferrocene. Molecular Physics 9 (3): 247–255. doi:10.1080/00268976500100321.
2.png.webp)
.png.webp)