Дентатність
Дента́тність (рос. дентатность, англ. denticity) — кількісна характеристика донорно-акцепторних властивостей лігандів, що визначається як число координаційних місць, які певний ліганд займає у внутрішній координаційній сфері комплексу. Ліганд може бути монодентатним, якщо займає одне місце, та полідентатним (наприклад, бідентатним), якщо займає кілька місць.

Дентатність ліганду позначається грецькою літерою κ ("каппа").[1] Наприклад, запис κ6-EDTA вказує, що ліганд EDTA є координованим до цетрального атому металу комплексної сполуки через шість несуміжних атомів.
Дентатність слід відрізняти від гаптичності ліганда, так як термін "гаптичність" використовується лише у випадках, коли ліганд є координованим до центрального атому через суміжні атоми. У цьому випадку у записі виористовується літера η ("ета").[2]
Для запису "місткових" лігандів, тобто таких, які координовані до двох атомів металу використовують μ ("мю").[3][4]
Термін походить від латинського слова dentis, що перекладається як "зуб".
Типи
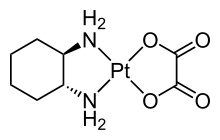
Полідентатні ліганди є хелатуючими агентами і їх класифікують за їхньою дентатністю.[5]
- Бідентатні ліганди координуються через два атоми, наприклад, етилендіамін.
- Тридентатні ліганди координуються через три атоми, наприклад терпіридин. У випадку октаедричних комплексів, тридентатні ліганди зазвичай координуються двома способами "mer" (meridian) і "fac" (facial). У першому випадку —три атоми ліганда типу розміщені в площині, що проходить через центральний атом (металу) координаційного комплексу. У другому — три атоми ліганда розміщені в площині, що співпадає з однією з граней октаедра. Циклічні тридентатні ліганди такі як 1,4,7-триазоциклононан і 1,4,7-тритіоциклононан координуються шляхом fac.
- Тетрадентатні ліганди координуються через чотири атоми, наприклад, триетилентетрамін. Для різних геометрій центрального атома металу є можливими різна кількість ізомерів залежно від топології ліганда. Так, для металу з октаедричною координаційною сферою лінійні тетрадентатні ліганди, як триетилентетрамін, можуть координуватися трьома різними шляхами. "Триногі" тетрадентатні ліганди, як тріс(2-аміноетил)амін, координуючись до атому октаедричної геометрії залишають вільними для координаціїї ще дві (сусідні) cis-позиції. Багато макроциклів, що зустрічаються у природі, є тетрадентатними, наприклад, порфірин в гемі.
- Пентадентатні ліганди координуються через п’ять атомів, наприклад, етилендіамінтриоцтова кислота.
- Гексадентатні ліганди координуються через шість атомів, наприклад, EDTA (хоча ця сполука може координуватися і через чотири атоми).
- Ліганди дентатності вище шести відомі також. Наприклад, 1,4,7,10-тетраазоциклододекан-1,4,7,10-тетраацетат (відомий як DOTA) і діетилентриамінпентаацетат (відомий як DTPA) є октадентатними. Вони особливо широко використовуються для координації, зв’язування, іонів лантанідів, які зазвичай мають координаційні числа вище шести.

- Приклади структур полідентатних лігандів
 Бідентатний ліганд — етилендіамін, координація відбувається через атоми нітрогену аміногруп.
Бідентатний ліганд — етилендіамін, координація відбувається через атоми нітрогену аміногруп. Тридентатний ліганд — терпіридин, координація відбувається через атоми нітрогену піридину (гетероциклу).
Тридентатний ліганд — терпіридин, координація відбувається через атоми нітрогену піридину (гетероциклу).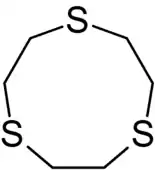 Тридентатний циклічний ліганд —1,4,7-тритіоциклононан, координація відбувається через атоми сульфуру.
Тридентатний циклічний ліганд —1,4,7-тритіоциклононан, координація відбувається через атоми сульфуру.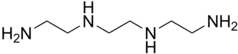 Тетрадентатний ліганд — триетилентетрамін, координація відбувається через атоми нітрогену аміногруп.
Тетрадентатний ліганд — триетилентетрамін, координація відбувається через атоми нітрогену аміногруп.amine.svg.png.webp) Тетрадентатний "триногий" ліганд — тріс(2-аміноетил)амін, координація відбувається через атоми нітрогену аміногруп.
Тетрадентатний "триногий" ліганд — тріс(2-аміноетил)амін, координація відбувається через атоми нітрогену аміногруп.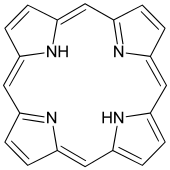
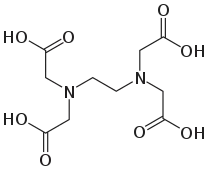 Гексадентатний ліганд — EDTA, координація відбувається через атоми нітрогену та оксигену. Якщо кооринація відбувається лише через атоми оксигену карбоксильних кислот — це тетрадентатний ліганд.
Гексадентатний ліганд — EDTA, координація відбувається через атоми нітрогену та оксигену. Якщо кооринація відбувається лише через атоми оксигену карбоксильних кислот — це тетрадентатний ліганд. Октадентатний ліганд — 1,4,7,10-тетраазоциклододекан-1,4,7,10-тетраацетат, координація відбувається через атоми нітрогену та оксигену.
Октадентатний ліганд — 1,4,7,10-тетраазоциклододекан-1,4,7,10-тетраацетат, координація відбувається через атоми нітрогену та оксигену.
Константа стійкості комплексу
Зазвичай, стійкість комплексу корелює з дентатністю ліганда. Так, полідентатні ліганди з дентатністю шість чи вісім зв’язуються з атомом металу сильніше ніж ліганди нижчої дентатності, в першу чергу, за рахунок ентропічних факторів. Константа стійкості комплексу є кількісним шляхом оцінки термодинамічної стійкості комплексної сполуки.
Джерела
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Примітки
- κ (kappa) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Процитовано 26.09.2020.
- η (eta or hapto) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Процитовано 26.09.2020.
- µ- (mu) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Процитовано 26.09.2020.
- bridging ligand. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Процитовано 26.09.2020.
- chelation. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Процитовано 26.09.2020.