Математичне моделювання інфекційних захворювань
Математичні моделі дають змогу продемонструвати розвиток інфекційних захворювань, щоб показати можливі наслідки епідемій та вчасно проінформувати заклади охорони здоров'я, щодо можливих спалахів хвороби. Ці моделі використовують деякі базові припущення в галузі медицини та математичні перетворення, для того щоб знайти параметри для різних інфекційних захворювань, та використати ці параметри для обчислення наслідків від можливих заходів, таких як програма масової вакцинації.
Історія
Першопрохідцями в моделюванні інфекційних захворювань були: Вільям Гамер[1] та Рональд Росс, який на початку XX століття застосував закон дії мас, щоб пояснити поведінку епідемії. Ловелл Рід і Вейд Гемптон Фрост розробили епідемічну модель Reed-Frost, щоб описати зв'язок між сприйнятливими до захворювання, інфікованими і тими що набули імунітету особинами в популяції.
Подальшим розвитком відповідної теорії стала так звана SIR модель, розроблена у 1920-х роках О. Кермаком та Андерсоном Греєм МакКендріком[2].
Загальні поняття
- R0
- середнє число особин популяції, кожна з яких може заразити осіб популяції, які не мають імунітету до цього захворювання.
- S
- частина особин популяції сприйнятливих до захворювання.
- A
- середній вік особин популяції, в якому спадає чисельність інфікованих особин для заданої популяції.
- L
- середня тривалість життя для даної популяції.
Припущення
Моделі залежать від припущень на яких вони базуються. Якщо отримані результати моделі не відповідають спостереженням і математичне формулювання є коректним, то нам слід змінити початкові умови, щоб мати змогу використати задану модель.
- Прямокутний, стаціонарний розподіл за віком, тобто кожна особина популяції живе до часу L, а потім помирає, також кожна вікова категорія популяції має однакову чисельність. Це часто використовується в розвинутих країнах, де існує низька дитяча смертність і висока тривалість життя.
- Рівномірне змішування популяції, тобто особини популяції вступають в контакт випадковим чином і здебільшого не змішуються в менші підгрупи. Це припущення рідко знаходить своє виправдання, оскільки соціальні структури є широко поширеними. Наприклад, більшість мешканців Лондона вступають в контакт переважно з іншими мешканцями Лондона. Крім того, в Лондоні є менші підгрупи, такі як турецька громада, або спільнота осіб підліткового віку, які змішуються одні з одними набагато більше, ніж поза межами своїх спільнот. Проте однорідне змішування є стандартним припущенням, для того щоб отримати змогу побудувати математичну модель.
Стан стійкості ендемічних захворювань
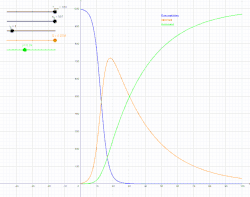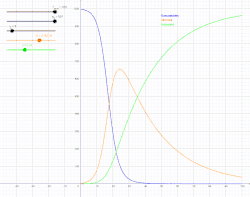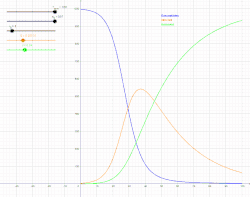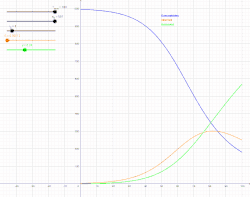
Інфекційна хвороба є ендемічною в популяції, коли ця хвороба постійно підтримується в цій популяції без потреби в зовнішніх джерелах. Це означає, що, в середньому, кожна інфікована особа заражає рівно одну особину (більше того, кількість інфікованих людей буде зростати експоненційно, що спричинить епідемію, проте з часом хвороба спадатиме). В математичних позначеннях, це означатиме, що:
Коефіцієнт поширення (R0) захворювання, припускаючи, що кожна особа є сприйнятливою до захворювання, помножений на частку осіб популяції, сприйнятливих до захворювання (S), повинен бути визначеним єдиним чином (тому особини, які не є сприйнятливими до захворювання, не враховуватимуться в обчисленнях, так як вони не можуть бути інфікованими). Зауважимо, для того щоб захворювання перебувало в стані стійкості, необхідно, щоб виконувалось наступне співвідношення: чим більший коефіцієнт поширення захворювання, тим менше число осіб популяції, схильних до захворювання, і навпаки. Припустимо, що заданий прямокутний, стаціонарний розподіл за віком та однакове поширення інфекції на кожну вікову групу популяції. Нехай A — середній вік особин, на яких поширюється інфекція, причому особи молодші за A є сприйнятливими до захворювання, а ті, які старші, — несприйнятливі. Тоді можна показати, що частка осіб популяції, сприйнятливих до захворювання, задається як:
Проте, згідно з визначенням стану стійкості ендемічного захворювання:
Тому згідно з транзитивним відношенням:
Використавши вхідні дані, отримуємо простий спосіб оцінки параметра R0. Для населення з експоненційним віковим розподілом
Це дає змогу обчислити коефіцієнт поширення захворювання для будь-якого розподілу популяції.
Динаміка інфекційних захворювань
Математичні моделі повинні об'єднувати в собі зростаючий об'єм даних, викликаний хост-патогенними взаємодіями. Багато теоретичних досліджень динаміки росту популяцій, структури та еволюції інфекційних захворювань рослин і тварин, включаючи людей, є пов'язаними із цією проблемою. Зокрема є такі напрямки досліджень:
- поширення та контроль захворювання
- епідеміологічні мережі
- просторова епідеміологія
- імунна епідеміологія
- вірулентність
- штам структури і взаємодії
- антигенна мутація
- генетика популяції мікроорганізмів
- роль генетичних чинників хазяїна організму
- статистичні та математичні інструменти та інновації
- роль та ідентифікація місць поширення інфекції
Математичний опис вакцинації популяції
Якщо частка осіб, які мають імунітет до захворювання, перевищує колективний імунітет для цього захворювання, то в цій популяції, інфекція не може поширюватись. Також це співвідношення може бути перевищеним при вакцинації населення, що призводить до усунення хвороби. Прикладом успішного використання вакцинації є подолання спалахів віспи у світі(останній раз глобальний спалах якої був у 1977 році). ВООЗ проводить схожу кампанію вакцинації з викорінення поліомієліту. Позначимо q — рівень колективного імунітету. Нагадаємо, що для стану стійкості:
S буде рівним (1 − q), оскільки q — частка популяції, яка має імунітет і q + S має бути рівним одиниці(так як в цій спрощеній моделі, кожна особина популяції є або сприйнятливою до захворювання, або має імунітет). Тоді:
Зауважимо, що рівень колективного імунітету є граничним. Якщо частка осіб з імунітетом перевищує цей рівень, в результаті програми масової вакцинації, хвороба буде відмирати. У проведених вище обчисленнях, ми знайшли поріг критичної імунізації популяції(позначається, як qc). Це мінімальна частка популяції, яка повинна бути імунізованою при народженні (або близько до народження) для того, щоб інфекція не мала змоги поширюватись в популяції.
Вакцинація популяції не перевищує рівня колективного імунітету
Якщо вакцинація популяції є недостатньою(наприклад у зв'язку із великим опором населення), кількість вакцинованого населення може не перевищувати поріг критичної імунізації. В результаті цього може порушитись збереження рівноваги поширення інфекції, що може викликати непередбачувані наслідки. Припустимо, що частка населення q (де q < qc) є вакцинованою від інфекції з народження із R0>1. Програма вакцинації змінилась із R0 до Rq, де
Ця зміна стає можливою завдяки зменшенню кількості особин сприйнятливих до захворювання, які можуть бути інфікованими. Rq дорівнюватиме R0 мінус ті особини, які зазвичай є зараженими, проте в даний момент мають імунітет. Внаслідок цього середній вік особин, на яких поширюється інфекція A, також зміниться на деяке нове значення Aq, тих осіб, які залишились не щепленими. Використаємо описаний вище зв'язок між R0, A та L. Якщо припустити, що середня тривалість життя не змінилася, отримуємо:
Проте R0 = L/A тому:
Таким чином, програма вакцинації підвищить середній вік інфекції. Не вакциновані особи відчуватимуть зменшену силу дії інфекції через присутність вакцинованих. Тим не менш, важливо враховувати позитивний ефект при вакцинації проти захворювань, які мають більш серйозні прояви, у літніх людей. Програма вакцинації проти захворювання, яке не перевищує qc, може викликати більше смертей і ускладнень, ніж було до того, як програма була введена в дію, якщо люди будуть хворіти пізніше. Ці непередбачувані результати програми вакцинації називаються небажаними наслідками.
Вакцинація популяції перевищує рівень колективного імунітету
Якщо в результаті програми вакцинації частка особин популяції, в яких є імунітет, перевищує критичний поріг, поширення інфекційних захворювань в цій популяції припиниться.
Див. також
Примітки
- Hamer, W. (1928). Epidemiology Old and New. London: Kegan Paul
- Слюсар В.И. Data Farming на основе пандемической статистики.//I Міжнародна науково-практична Інтернет-конференція «Вплив пандемії COVID-19 на розвиток сучасного світу: загрози та можливості». 9 – 10 вересня 2021. – Дніпро. – С. 174 - 177.
Література
- Anderson, Roy M.; May, Robert M. Infectious Diseases of Humans. ISBN 0-19-854040-X.
- Keeling, Matt; Rohani, Pej. Modeling Infectious Diseases: In Humans and Animals. Princeton: Princeton University Press.
- Vynnycky, Emilia; White, Richard G. An Introduction to Infectious Disease Modelling. Процитовано 15 лютого 2016. An introductory book on infectious disease modelling and its applications.
- Jenner. Smallpox and its Eradication.
- Riley S (June 2007). Large-scale spatial-transmission models of infectious disease. Science 316 (5829): 1298–301. PMID 17540894. doi:10.1126/science.1134695.
Посилання
- Institute for Disease Modeling
- Institute for Emerging Infections, University of Oxford
- Center for Infectious Disease Modeling and Analysis, Yale School of Public Health
- Center for Infectious Disease Dynamics, The Pennsylvania State University
- Cambridge Infectious Diseases
- Centre for the Mathematical Modelling of Infectious Diseases, London School of Hygiene & Tropical Medicine
- Models of Infectious Disease Agent Study
- Infectious Disease Modeling: Measles Virus
- Model-Builder: Interactive (GUI-based) software to build, simulate, and analyze ODE models.
- Tuberculosis Modelling and Analysis Consortium (TB MAC): Group focused on improving global Tuberculosis control by coordinating and promoting mathematical modelling and other quantitative research activities.
- GLEaMviz Simulator: Enables simulation of emerging infectious diseases spreading across the world.
- STEM: Open source framework for Epidemiological Modeling available through the Eclipse Foundation.
