Полігамні моделі в епідеміології
Поява та поширення інфекційних захворювань, являє собою складний механізм взаємодіючих факторів, таких як навколишнє середовище в якому розташовані хвороботворні мікроорганізми й організми, які їх переносять, а також внутрішня та зовнішня динаміка населення.
Математичне моделювання в епідеміології дає змогу змоделювати появу й поширення хвороботворних мікроорганізмів. Для цього населення поділяють на певні групи осіб, в залежності від стану здоров'я та рівня поширення збудника в популяції. Однією з базових моделей, яка була успішно дослідженою, стала модель Кермака-МакКендріка, побудована в 1927—1933 роках[1][2][3] (оригінальні статті тих часів було передруковано 1991 року).
Ці моделі відомі як полігамні моделі в епідеміології, а також слугують базовими математичними моделями, які дають змогу зрозуміти складну динаміку та основні особливості цих систем. В найпростішому випадку населення поділяють на дві групи: сприйнятливих до захворювання осіб (позначають, як S — від англ. susceptible), та осіб інфікованих патогеном (позначають, як I — від англ. infected). Таким чином, патогенна взаємодія базується на феноменологічних припущеннях, на основі яких побудована математична модель. Для дослідження цих моделей використовують звичайні диференціальні рівняння (які є детермінованими), проте можна розглядати й стохастичні моделі (наприклад, модель Ґіллеспі). В подальшому використанні цих моделей, також описується кількість осіб, які одужали (позначають, як R — від англ. recovered).
Отримавши змогу моделювати поширення інфекційних патогенів у полігамних моделях, стає можливим спрогнозувати різні властивості патогена, наприклад, поширення (загальну кількість осіб інфікованих від епідемії) та тривалість епідемії. Крім того, стає можливим зрозуміти можливі наслідки епідемії за різних ситуацій, наприклад, в який спосіб найкраще проводити вакцинацію населення, за обмеженої кількості вакцин.
Модель SIR
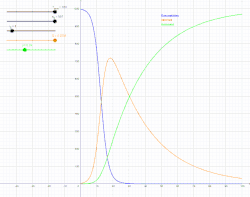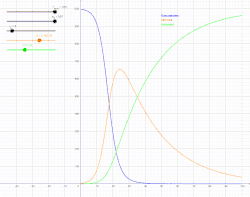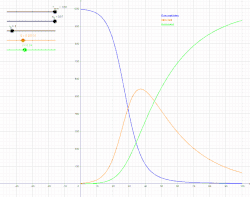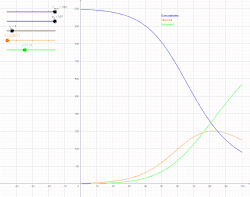
SIR модель включає поділ населення на три групи: S - кількість осіб сприйнятливих до захворювання, I - кількість інфікованих осіб та R - кількість осіб, які одужали й мають імунітет або загинули[4].
Ця модель не є складною при розв'язуванні й водночас дає змогу моделювати поширення багатьох інфекційних захворювань, в тому числі кору, ендемічного паротиту та краснухи, а також оцінити ефективність карантинних заходів різної тривалості. Крім того, SIR модель може використовуватися для моделювання динаміки антагоністичних протистоянь[5], а також як основа методології вирощування даних (Data Farming) для тренування і тестування нейронних мереж[4].
Для того щоб, показати, що значення S, I, R змінюються з часом (навіть якщо загальна чисельність населення залишається незмінною), їх слід позначити як залежні від часу функції S(t), I(t) та R(t). Ці функції будуть змінювати в залежності від захворювання та популяції, щоб мати змогу спрогнозувати можливі спалахи й взяти їх під контроль.
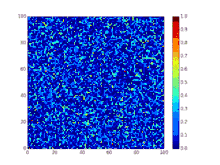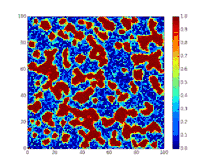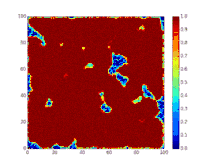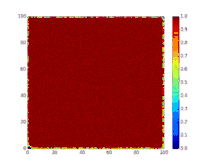
Детермінована біо-математична SIR модель
SIR модель, без врахування життєвого циклу населення
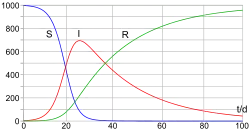
Динаміка розвитку епідемії, наприклад, грипу, часто набагато швидша, ніж динаміка народження і смерті населення, тому, в простих полігамних моделях життєвий цикл населення досить часто опускається. SIR модель без врахування життєвого циклу населення(народження і смерті, або інколи називають демографією) може бути описана наступною системою диференціальних рівнянь:[6]
- ,
- ,
- .
Ця модель вперше була запропонована О. Кермаком та Андерсоном Греєм МакКендріком[4], особливий випадок якої називається теорією Кермака-МакКендріка.
Ця система є нелінійною й немає узагальненого аналітичного розв'язку. Проте, певні результати цієї моделі можуть бути отриманими аналітично.
По-перше, зауважимо, що:
- ,
звідси випливає, що:
- ,
де - чисельність населення, яка вважається сталою. Слід зазначити, що вищенаведене співвідношення означає, що постає необхідність розв'язувати рівняння, для двох із трьох змінних.
По-друге, слід зазначити, що динаміка інфекційного захворювання залежить від наступного співвідношення:
- ,
тут - коефіцієнт поширення інфекції. Це співвідношення показує число нових випадків поширення інфекції, де всі особи є сприйнятливими до захворювання.[7][8] Ми зможемо краще зрозуміти цю ідею, якщо позначимо час контакту між особою й інфекцією , та час одужання . Звідси випливає, що, в середньому, кількість контактів зараженої людини з іншими людьми, перш ніж вона одужає дорівнюватиме
Поділивши перше диференціальне рівняння на третє, відокремивши змінні та проінтегрувавши отримуємо:
- ,
де та початкові значення сприйнятливих до захворювання й тих, що одужали осіб відповідно. Таким чином спрямувавши , частка осіб, які одужали відповідатиме наступному рівнянню:
- .
Це рівняння показує, що в кінці епідемії, навіть якщо , не всі особи популяції одужали, тому повинно залишатись певне число осіб сприйнятливих до захворювання. Це означає, що кінець епідемії спричинений скороченням числа інфікованих людей, а не повною відсутність сприйнятливих до захворювання осіб. Роль коефіцієнта поширення інфекції є надзвичайно важливою. Справді, переписавши рівняння зміни кількості інфікованих осіб наступним чином:
- ,
отримуємо, якщо:
тоді
тобто відбудеться спалах епідемії зі зростанням числа інфікованих осіб. І навпаки, якщо
тоді
тобто, незалежно від початкової кількості сприйнятливих до захворювання осіб, хвороба ніколи не зможе спричинити спалах епідемії.
Сила дії інфекції
Зверніть увагу,що наведена раніше функція:
яка моделює швидкість зміни сприйнятливих до захворювання осіб на інфікованих є силою дії інфекції. Однак для багатьох груп інфекційних захворювань, більш реалістично розглядати силу дії інфекції, яка залежить не від числа інфікованих осіб, а від частки цих осіб відносно всього населення:
Аналітичний розв'язок для SIR моделі
У 2014 році Harko T. та ін.[9] отримали точний аналітичний розв'язок SIR моделі. У моделі без врахування життєвого циклу населення, для , тобто забезпечується відповідність часовій параметризації
для , , з початковими умовами , де задовольняє . З рівняння, описаного вище, для випливає що, , якщо та .
Див. також
- Математичне моделювання інфекційних захворювань
- Modifiable Areal Unit Problem
- Next-generation matrix
- Risk assessment
- Attack rate
Примітки
- Kermack, W; McKendrick, A (1991). Contributions to the mathematical theory of epidemics – I. Bulletin of Mathematical Biology 53 (1–2): 33–55. PMID 2059741. doi:10.1007/BF02464423.
- Kermack, W; McKendrick, A (1991). Contributions to the mathematical theory of epidemics – II. The problem of endemicity. Bulletin of Mathematical Biology 53 (1–2): 57–87. PMID 2059742. doi:10.1007/BF02464424.
- Kermack, W; McKendrick, A (1991). Contributions to the mathematical theory of epidemics – III. Further studies of the problem of endemicity. Bulletin of Mathematical Biology 53 (1–2): 89–118. PMID 2059743. doi:10.1007/BF02464425.
- Слюсар В.И. Data Farming на основе пандемической статистики.//I Міжнародна науково-практична Інтернет-конференція «Вплив пандемії COVID-19 на розвиток сучасного світу: загрози та можливості». 9 – 10 вересня 2021. – Дніпро. – С. 174 - 177.
- Slyusar V. On the Issue of Assessing the Effectiveness of Air Defense Based on a Pandemic Model. // EasyChair preprint No. 4173. - September 13, 2020. – 4 p.
- Hethcote H (2000). The Mathematics of Infectious Diseases. SIAM Review. 42 (4): 599–653.
- Bailey, Norman T. J. (1975). The mathematical theory of infectious diseases and its applications (вид. 2nd). London: Griffin. ISBN 0-85264-231-8.
- Sonia Altizer; Nunn, Charles (2006). Infectious diseases in primates: behavior, ecology and evolution. Oxford Series in Ecology and Evolution. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-856585-2.
- Harko T., Lobo F.S.N., and Mak M.K. (2014). Exact analytical solutions of the Susceptible-Infected-Recovered (SIR) epidemic model and of the SIR model with equal death and birth rates.. Applied Mathematics and Computation 236: 184–194.
Література
- May, Robert M.; Anderson, Roy M. (1991). Infectious diseases of humans: dynamics and control. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-854040-X.
- V. Capasso, The Mathematical Structure of Epidemic Systems, Springer Verlag (1993)
- McKendrick AG (1925). Applications of mathematics to medical problems. Proceedings of the Edinburgh Mathematical Society 44: 98–130. doi:10.1017/S0013091500034428.
Reprinted with commentary in Johnson, Norman L.; Kotz, Samuel (1992). Breakthroughs in statistics 3. Berlin: Springer-Verlag. ISBN 0-387-94989-5. - Hethcote H (1976). Qualitative analyses of communicable disease models. Math. Biosci. 28 (3-4): 335–356. doi:10.1016/0025-5564(76)90132-2. Архів оригіналу за 20 листопада 2009. Процитовано 17 травня 2017.
- Inaba H (1990). Threshold and stability results for an age-structured epidemic model. J Math Biol 28 (4): 411–34. PMID 2384720.
- Nasell, I. (2002). Measles outbreaks are not chaotic. У Blower, Sally; Castillo-Chávez, Carlos. Mathematical approaches for emerging and reemerging infectious diseases: an introduction. Berlin: Springer. с. 85–115. ISBN 0-387-95354-X.
- d'Onofrio A (2002). Stability properties of pulse vaccination strategy in SEIR epidemic model. Math Biosci 179 (1): 57–72. PMID 12047921. doi:10.1016/S0025-5564(02)00095-0.
- d'Onofrio A (2004). Mixed pulse vaccination strategy in epidemic model with realistically distributed infectious and latent times. Applied Mathematics and Computation 151 (1): 181–7. doi:10.1016/S0096-3003(03)00331-X.
- Vynnycky, E.; White, R.G. (2010). У Vynnycky, E.; White, R.G. An Introduction to Infectious Disease Modelling. Oxford: Oxford University Press. с. 368. ISBN 0-19-856576-3.
Посилання
- A Preliminary Mathematical Model for the Dynamic Transmission of Dengue, Chikungunya and Zika by Raul Isea and Karl E Lonngren (2016).
- SIR model: Online experiments with JSXGraph
