Оксид рубідію
Оксид рубідію — неорганічна бінарна сполука Рубідію та Оксигену складу Rb2O. Являє собою світло-жовті кристали, які при нагріванні темнішають. Проявляє сильні осно́вні властивості. У природі розповсюджений у складі мінералів лепідоліту, амазоніту та полуциту.
| Оксид рубідію | |
|---|---|
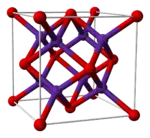 Кристалічна ґратка Rb2O | |
| Назва за IUPAC | Рубідій оксид |
| Ідентифікатори | |
| Номер CAS | 18088-11-4 |
| Номер EINECS | 241-993-2 |
| SMILES | |
| InChI |
InChI=1S/2O.Rb/q2*-2;+1 |
| Властивості | |
| Молекулярна формула | Rb2O |
| Молярна маса | 186,935 г/моль |
| Зовнішній вигляд | жовті кристали |
| Густина | 4,0 г/см³[1] |
| Тпл | 400 °C (розкладається)[1] |
| Розчинність (вода) | реагує |
| Пов'язані речовини | |
| Інші аніони | гідроксид рубідію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Поширення у природі

Оксид рубідію поширений у земній корі разом із оксидом цезію в породах, багатих на SiO2 та Al2O3. Основними представниками мінералів, які містять оксид рубідію є лепідоліт, амазоніт та полуцит (містить Rb2O у вигляді домішок). Для отримання оксиду рубідію зазвичай використовують лепідоліт та полуцит.
Невеликі кількості оксиду рубідію були знайдені у кременистих метеоритах.
Фізичні властивості
Оксид рубідію являє собою світло-жовті кристали, які при нагріванні темнішають до яскраво-жовтих. Стійкий на сухому повітрі. Дана сполука є світлочутливою: при дії світла темнішає та розкладається.
Отримання
Оксид рубідію можна синтезувати взаємодією рубідію з киснем на холоді:
При звичайних температурах продуктом спалювання рубідію є його супероксид. Тривалим прокалюванням супероксиду можна отримати оксид:
Оксид також утворюється при прокалювання карбонату рубідію:
Хімічні властивості
За підвищених температур оксид рубідію розкладається:
Він активно взаємодіє з водою, утворюючи сильнолужний розчин гідроксиду рубідію:
Пропускаючи водень через розігрітий Rb2O, утворюється його гідрид:
Проявляє сильні осно́вні властивості, реагуючи з кислотами, кислотними оксидами а також рідким амоніаком:
Див. також
- Гідроксид рубідію
- Супероксид рубідію
Примітки
- За тиску 101,3 кПа
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)