Первинний антигенний гріх
Первинний антигенний гріх (англ. Original antigenic sin),[1] також відомий як антигенний імпринтинг або ефект Хоскінса (англ. the Hoskins effect)[2] — схильність імунної системи організму переважно використовувати імунологічну вже існуючу пам’ять на основі попередньої інфекції, при зустрічі з другою, трохи іншою версією цього чужорідного збудника (наприклад, вірусу або бактерії). Це залишає імунну систему "заблокованою" першою реакцією, яку вона зробила на кожен антиген, і не спроможною забезпечити потенційно більш ефективні відповіді під час наступних інфекцій. Антитіла або Т-клітини, індуковані під час інфекцій з першим варіантом збудника, підлягають формі первинного антигенного гріха, відомому, як заморожування репертуару.
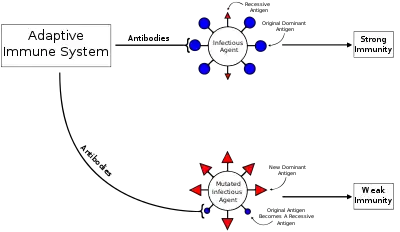
Явище первинного антигенного гріха було описано стосовно вірусу грипу, лихоманки денге, вірусу імунодефіциту людини (ВІЛ)[3] та кількох інших вірусів.[4]
Вперше це явище було описане у 1960 році Томасом Френсісом молодшим у статті "Про вчення про первородний антигенний гріх" (англ. "On the Doctrine of Original Antigenic Sin").[5][6] Він названий за аналогією з теологічною концепцією первородного гріха. За словами Френсіса, за цитатою Річарда Краузе:[6]
«Антитіла дитинства значною мірою є реакцією на домінантний антиген вірусу, що викликає першу інфекцію грипу типу А протягом життя. [...] Відбиток, встановлений початковою вірусною інфекцією, визначає реакцію антитіл після цього. Це ми назвали вченням про первинний антигенний гріх».
У В-клітинах
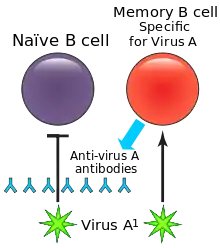
Під час первинної інфекції утворюються довгоживучі В-клітини пам’яті, які залишаються в організмі та забезпечують захист від наступних інфекцій. Ці В-клітини реагують на специфічні епітопи на поверхні вірусних білків, щоб виробляти антиген-специфічні антитіла, і здатні реагувати на інфекцію набагато швидше, ніж В-клітини здатні реагувати на нові антигени. Цей ефект скорочує час, необхідний для очищення наступних інфекцій.
Між первинними та вторинними інфекціями або після вакцинації вірус може зазнати антигенного дрейфу, при якому поверхневі білки вірусу (епітопи) змінюються шляхом природної мутації, що дозволяє вірусові уникнути імунної відповіді. Коли це відбувається, змінений вірус переважно активує раніше активовані В-клітини з високою спорідненістю пам'яті та стимулює вироблення антитіл. Однак, антитіла, вироблені цими В-клітинами, зазвичай неефективно чіпляються до змінених епітопів. Крім того, ці антитіла пригнічують активацію наївних В-клітин з більш високою спорідненістю, які могли б виробляти більш ефективні антитіла до другого вірусу. Це призводить до менш ефективної імунної відповіді, і для усунення рецидивуючих інфекцій може знадобитися більше часу.[7]
Первинний антигенний гріх має особливе значення у застосуванні вакцин.[8] При лихоманці денге вплив первинного антигенного гріха має важливі наслідки для розробки вакцини. Після того, як буде встановлено імунну відповідь проти серотипу вірусу денге, малоймовірно, що щеплення проти другої буде ефективною, що означає, що збалансовану реакцію проти всіх чотирьох серотипів вірусу необхідно встановити з першою дозою вакцини.[9]
Специфічність та якість імунної відповіді проти нових штамів грипу часто знижуються у осіб, які неодноразово імунізовані (шляхом вакцинації або рецидивуючих інфекцій).[10] Однак вплив антигенного гріха на захист не був добре встановлений і, схоже, різниться між вакцинами, географічного розташування та віку.[11] Дослідники виявили знижену реакцію антитіл на пандемічну вакцину проти грипу H1N1 2009 року у осіб, які були вакциновані проти сезонного A/Brisbane/59/2007 (H1N1) протягом останніх трьох місяців.[12]
У цитотоксичних Т-клітинах
Подібне явище було описане в цитотоксичних Т-клітинах (ЦТЛ).[13] Було продемонстровано, що під час другої інфекції іншим штамом вірусу денге, ЦТЛ воліють вивільняти цитокіни, а не викликати лізис клітин. В результаті цього вважається, що вироблення цих цитокінів збільшує проникність судин і посилює пошкодження ендотеліальних клітин, явище, відоме як геморагічна гарячка денге.[14]
Кілька груп намагалися розробити вакцини проти ВІЛ та гепатиту С на основі індукції реакції ЦТЛ. Висновок про те, що реакція ЦТЛ може бути упередженою первинним антигенним гріхом, може допомогти пояснити обмежену ефективність цих вакцин. Віруси, такі як ВІЛ, дуже мінливі і часто зазнають мутацій; через первинний антигенний гріх, інфекція ВІЛ, індукована вірусами, які експресують дещо інші епітопи (ніж ті, що містяться у вірусній вакцині), не може бути контрольована вакциною. Насправді, вакцина може погіршити інфекцію, "затримавши" імунну відповідь на першу, неефективну реакцію, яку вона зробила проти вірусу.[15]
Див також
- Антитілозалежне посилення інфекції
- Клітинний імунітет
- Гуморальний імунітет
- Поліклональна відповідь
Джерела
- Thomas Francis Jr (1960). On the doctrine of original antigenic sin. Proceedings of the American Philosophical Society 104 (6): 572–578. JSTOR 985534.
- FDA Center for Biologics Evaluation and Research Vaccines and Related Biological Products: Advisory Committee(RTF)
- Singh, Rana AK; Rodgers, John R; Barry, Michael A (2002). The role of T cell antagonism and original antigenic sin in genetic immunization. The Journal of Immunology 169 (12): 6779––6786. doi:10.4049/jimmunol.169.12.6779. Процитовано 14 травня 2021.
- Deem, Michael W.The Adaptive Immune Response Rice University
- Thomas Francis Jr (1960). On the doctrine of original antigenic sin. Proceedings of the American Philosophical Society 104 (6): 572–578. JSTOR 985534.
- Krause R (2006). The swine flu episode and the fog of epidemics. Emerg Infect Dis 12 (1): 40–43. PMC 3291407. PMID 16494715. doi:10.3201/eid1201.051132.
- Can successful vaccines teach us how to induce efficient protective immune responses?. Nat Med 11 (4 Suppl): S54–62. 2005. PMID 15812491. doi:10.1038/nm1216.
- Choi, Yoon Seok; Baek, Yun Hee; Kang, Wonseok та ін. (September 2011). Reduced Antibody Responses to the Pandemic (H1N1) 2009 Vaccine after Recent Seasonal Influenza Vaccination. Clinical and Vaccine Immunology 18 (9): 1519–1523. PMC 3165229. PMID 21813667. doi:10.1128/CVI.05053-11.
- Midgley, Claire M.; Bajwa-Joseph, Martha; Vasanawathana, Sirijitt та ін. (January 2011). An In-Depth Analysis of Original Antigenic Sin in Dengue Virus Infection. Journal of Virology 85 (1): 410–421. PMC 3014204. PMID 20980526. doi:10.1128/JVI.01826-10.
- Kim, J.H.; Skountzou, I.; Compans, R.; Jacob, J. (1 вересня 2009). Original antigenic sin responses to influenza viruses.. Journal of Immunology 183 (5): 3294–301. PMC 4460008. PMID 19648276. doi:10.4049/jimmunol.0900398.
- Can successful vaccines teach us how to induce efficient protective immune responses?. Nat Med 11 (4 Suppl): S54–62. 2005. PMID 15812491. doi:10.1038/nm1216.
- Choi, Yoon Seok; Baek, Yun Hee; Kang, Wonseok та ін. (September 2011). Reduced Antibody Responses to the Pandemic (H1N1) 2009 Vaccine after Recent Seasonal Influenza Vaccination. Clinical and Vaccine Immunology 18 (9): 1519–1523. PMC 3165229. PMID 21813667. doi:10.1128/CVI.05053-11.
- McMichael AJ (1998). The original sin of killer T cells. Nature 394 (6692): 421–422. PMID 9697760. doi:10.1038/28738.
- Juthathip Mongkolsapaya (2006). T Cell Responses in Dengue Hemorrhagic Fever: Are Cross-Reactive T Cells Suboptimal?. J. Immunol. 176 (6): 3821–3829. PMID 16517753. doi:10.4049/jimmunol.176.6.3821.
- McMichael AJ (1998). The original sin of killer T cells. Nature 394 (6692): 421–422. PMID 9697760. doi:10.1038/28738.